
将0.2 mol·L-1 NaHCO3溶液与0.1 mol·L-1 KOH溶液等体积混合,下列关系正确的是 ( )
A.2c(K+)=c(HCO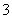 )+2c(CO
)+2c(CO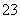 )+c(H2
)+c(H2 CO3)
CO3)
B.c(Na+)>c(K+)>c(HCO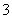 )>c(CO
)>c(CO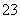 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.c(OH-)+c(CO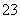 )=c(H+)+c(H2CO3)+0.1 mol·L-1
)=c(H+)+c(H2CO3)+0.1 mol·L-1
D.3c(K+)+c(H+)=c(OH- )+c(HCO
)+c(HCO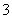 )+2c(CO
)+2c(CO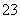 )
)
科目:高中化学 来源: 题型:
已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH:
| 溶质 | NaHCO3 | Na2CO3 | NaCN |
| pH | 9.7 | 11.6 | 11.1 |
下列说法中正确的是( )
A.阳离子的物质的量浓度之和:
Na2CO3>NaCN>NaHCO3
B.相同条件下的酸性:H2CO3<HCN
C.三种溶液中均存在电离平衡和水解平衡
D.升高Na2CO3溶液的温度,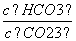 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下,AgBr的Ksp=4.9×10-13、AgI的Ksp=8.3×10-17。
(1)现向含有AgI的饱和溶液中:
①加入固体AgNO3,则c(I-)________(填“变大”“变小”或“不变”,下同);
②若改加更多的AgI,则c(Ag+)________;
③若改加AgBr固体,则c(I-)________;而c(Ag+)________。
(2)现向含有NaBr、KI均为0.002 mol/L的溶液中加入等体积的浓度为4×10-3 mol/L AgNO3溶液,则产生的沉淀是________(填化学式);若向其中再加入适量的NaI固体 ,则最终可发生沉淀转化的总反
,则最终可发生沉淀转化的总反 应式表示为____________________________。
应式表示为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将氨水滴加到盛有AgCl浊液的试管中,AgCl逐渐溶解,再加入NaBr溶液又产生了浅黄色沉淀。对上述过程,下列理解或解释中正确的是( )
A.Ksp(AgCl)<Ksp(AgBr)
B.若在AgCl浊液中直接加入NaB r溶液,也会产生浅黄色沉淀
r溶液,也会产生浅黄色沉淀
C.上述实验说明AgCl没有NaBr稳定
D.因为Ksp(AgCl)>Ksp(AgOH),故氨水能使AgCl溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列各溶液中,微粒的物质的量浓度关系表述正确的是 ( )
A.0.1 mol·L-1的(NH4)2CO3溶液中:c(CO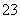 )>c(NH
)>c(NH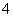 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.0.1 mol·L-1的NaHCO3溶液中:c(Na+)=c(HCO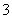 )+c(H2CO3)+2c(CO
)+c(H2CO3)+2c(CO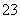 )
)
C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸等体积混合所得碱性溶液中:
c(Na+)+c(H+)=c(A-)+c(Cl-)
D.在25 ℃时,1 mol·L-1的CH3COONa溶液中:c(OH-)=c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol·L-1CH3COONa溶液与0.1 mol·L-1HCl溶液等体积混合:
c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.0.1 mol·L-1NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7):
c(NH3·H2O)>c(NH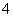 )>c(Cl-)>c(OH-)
)>c(Cl-)>c(OH-)
C.0.1 mol·L-1Na2CO3溶液与0.1 mol·L -1NaHCO3溶液等体积混合:
-1NaHCO3溶液等体积混合:
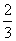 c(Na+)=c(CO
c(Na+)=c(CO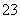 )+c(HCO
)+c(HCO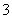 )+c(H2CO3)
)+c(H2CO3)
D.0.1 mol·L-1Na2C2O4溶液与0.1 mol·L-1HCl溶液等体积混合(H2C2O4为二元弱酸):
2c(C2O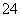 )+c(HC2O
)+c(HC2O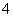 )+c(OH-)=c(Na+)+c(H+)
)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关二元弱酸H2A的盐溶液的说法,正确的是 ( )
A.在NaHA溶液中:c(Na+)>c(HA-)>c(OH-)>c(H+)
B.在NaHA溶液中:c(Na+)>c(HA-)>c(H+)>c(OH-)
C.在Na2A溶液中c(Na+)=c(HA-)+c(OH-)+c(A2-)
D.在Na2A溶液中c(OH-)=c(H+)+c(HA-)+2c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
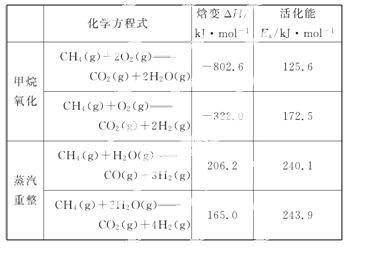
回答下列问题:
(1)反应CO(g)+H2O(g)====CO2(g)+H2(g)的ΔH=_____kJ·mol-1。
(2)在初始阶段,甲烷蒸汽重整的反应速率________甲烷氧化的反应速率(填“大于”“小于”或“等于”)。
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp),则反应CH4(g)+H2O(g)  CO(g)+3H2(g)的Kp=______;随着温度的升高,该平衡常数_________ (填“增大”“减小”或“不变”)。
CO(g)+3H2(g)的Kp=______;随着温度的升高,该平衡常数_________ (填“增大”“减小”或“不变”)。
(4)从能量角度分析,甲烷自热重整方法的先进之处在于___________________________________。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如图:
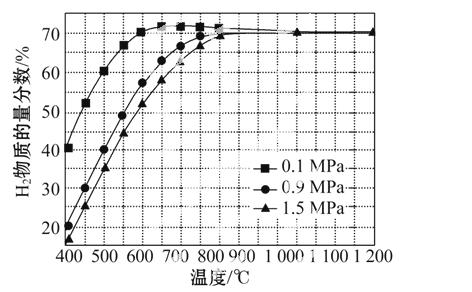
①若要达到H2物质的量分数>65%、CO物质的量分数<10%,以下条件中最合适的是______________。
A.600 ℃,0.9 MPa B.700 ℃,0.9 MPa
C.800 ℃,1.5 MPa D.1 000 ℃,1.5 MPa
②画出600 ℃,0.1 MPa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是:
A.把100mL3mol·L-1的H2SO4跟100mLH2O混合,硫酸的物质的量浓度变为1.5mol·L-1
B.把100g20%的NaCl溶液跟100gH2O混合后,NaCl溶液的溶质质量分数是10%
C.把200mL3mol·L-1的BaCl2溶液跟100mL3mol·L-1的KCl溶液混合后, 溶液中的C(Cl-)仍然是3mol·L-1
溶液中的C(Cl-)仍然是3mol·L-1
D.把100mL20%的NaOH溶液跟100mLH2O混合后,NaO H溶液的质量分数是10%
H溶液的质量分数是10%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com