

���� ��ȡ�ķ����Ǽ��������ˮʹ��Ʒ�ܽ⣬������ƿ������250ml��Һ����ȡ25.00ml��Һ��������ˮ���������������������ӡ����백ˮʹ�����ӳ��������˽���������������������������������Ȼ��ͨ������������������������������
��1����������һ�����ʵ���Ũ�ȵ���Һ����Ҫ�������У���Ͳ����ͷ�ιܡ��ձ�����������һ����������ƿ��
��2���ܽ�����ʱ��������������������������Ӻ��������ӵ�ˮ�⣬����II�м�����ˮ�������������������ӣ�
��3��������ˮ��Һ��һˮ�ϰ��������ӷ�Ӧ��������������������Σ�
��4���������������������������������ټ��ٺ���ȴ�����£�����������bg����������Ⱥ������������cg����õ�����������=cg-bg�������Ԫ���غ������Ʒ����Ԫ�ص�����������
��5��ij�Ȼ������Ȼ������Ļ�����Ҫ�ⶨ������Ԫ�ص���������������������ԭ�����������ᷴӦ�����������ӣ���������Ԫ�ص����Բⶨ���������
��6�����������Һ����ǿ�����������������������������ӣ�
��� �⣺��1��������һ�����ʵ���Ũ�ȵ���Һ����Ҫ�������У���Ͳ����ͷ�ιܡ��ձ�����������һ����������ƿ������I���õ��IJ����������ձ�����������250mL����ƿ�⣬�������н�ͷ�ιܣ�
�ʴ�Ϊ����ͷ�ιܣ�
��2���ܽ�����ʱ��������������������������Ӻ��������ӵ�ˮ�⣬����II�м�����ˮ���������������������������������������������ӣ�
�ʴ�Ϊ���������Ӻ��������ӵ�ˮ�⣻���������������������ӣ�
��3��������ˮ��Һ��һˮ�ϰ��������ӷ�Ӧ��������������������Σ���Ӧ�����ӷ���ʽΪ��3Fe3++3NH3•H2O=Fe��OH��3��+3NH4+��
�ʴ�Ϊ��3Fe3++3NH3•H2O=Fe��OH��3��+3NH4+��
��4���������������������������������ټ��ٺ���ȴ�����£�����������bg����������Ⱥ������������cg����õ�����������=cg-bg�����������ʵ���=$\frac{��c-a��g}{160g/mol}$����Ԫ�����ʵ���=$\frac{c-a}{160}$��2=$\frac{c-a}{80}$mol��250ml��Һ�к�Ԫ��$\frac{c-a}{80}$mol��$\frac{250}{25}$=$\frac{c-a}{8}$mol��
����Ʒ����Ԫ�ص���������=$\frac{\frac{c-a}{8}mol��56g/mol}{ag}$��100%=$\frac{7��c-a��}{a}$��100%��
�ʴ�Ϊ��$\frac{7��c-a��}{a}$��100%��
��5����ԭ��������������Ϊ�����ۻ�������ᷴӦ��������������������������������Fe2+�����ø�����صζ�������������������������ԭ��������Ԫ�صIJⶨ��
�ʴ�Ϊ���������������ԭ��������������������Fe2+���һ�����������ᷴӦ����Fe2+��������Ԫ�صIJⶨ��
��6����������KMnO4��Һ�ζ���Fe2+����Һ����Ӧ�����ӷ���ʽ��5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O��
�ʴ�Ϊ��5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O��
���� ���⿼������Һ���ƹ��̡�������ɵ�ʵ��ⶨ������ʵ����̷����жϡ���������Ӧ�ã����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
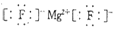 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 500mL 0.1mol/L MgCl2��Һ | B�� | 100mL 0.5mol/L AlCl3��Һ | ||
| C�� | 50mL1mol/L NaCl��Һ | D�� | 25mL 0.5mol/L HCl��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | KAl��SO4��2 ��Һ�� c��K+��=2c��SO42-�� | |
| B�� | ��NaHCO3��Һ�м�������Ba��OH��2���壬c��CO32-������ | |
| C�� | ����A gCl ��A gBr ���������Һ�У�C��Ag+����c��Cl-��=c��Br-�� | |
| D�� | ��ʹNa2S��Һ��$\frac{{c��N{a^+}��}}{{c��{S^{2-}}��}}$�ӽ���2��1���ɼ���������NaOH���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ϩ������̼̼˫��������ʹ���CCl4��Һ��ɫ | |
| B�� | ���� ����һ�ȴ�����һ�֣������һ�ȴ���Ҳ��һ�� ����һ�ȴ�����һ�֣������һ�ȴ���Ҳ��һ�� | |
| C�� | �Ҵ�����ϩ���������Ը�����ط�����Ӧ | |
| D�� | ���е��л��ﶼ������ȼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���ʼ��仯�����ڹ�ũҵ������������Ҫ��Ӧ�ã�
���ʼ��仯�����ڹ�ũҵ������������Ҫ��Ӧ�ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����� | B�� | ������ | C�� | �� | D�� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | 200��ʱ����Ӧ�ӿ�ʼ��ƽ���ƽ������ v��A��=0.08 mol•L-1•min-1 | |
| B�� | �� 0��5 min ʱ�����������Ƚ�������Ϊ m kJ����÷�Ӧ���Ȼ�ѧ����ʽ�ɱ�ʾΪ��2A��g��+B��g��?C��g����H=+5m kJ/mol | |
| C�� | 200��ʱ�����ڵ� 6 min ������ϵ�м����������ʹ v ����v �� | |
| D�� | 200��ʱ��ƽ����ٳ��� 2 mol C����ﵽƽ��ʱ����ѧƽ�ⳣ����С |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com