
 某条件下,在2L密闭容器中充入NO2发生如下反应:2NO2(g)?
某条件下,在2L密闭容器中充入NO2发生如下反应:2NO2(g)?分析 ①实验Ⅱ与实验Ⅰ相比,到达平衡时间缩短,平衡不移动;
实验Ⅲ与实验I相比,到达平衡时间缩短,反应速率增大,平衡时二氧化氮浓度减小,平衡逆向移动;
②二氧化氮起始浓度为1mol/L,实验I平衡时二氧化氮浓度为0.5mol/L,则:
2NO2(g)?2NO(g)+O2(g)
起始浓度(mol/L):1 0 0
变化浓度(mol/L):0.5 0.5 0.25
平衡浓度(mol/L):0.5 0.5 0.25
再根据K=$\frac{{c}^{2}(NO)×c({O}_{2})}{{c}^{2}(N{O}_{2})}$计算;
③恒温恒容下,增大生成物的浓度,平衡逆向移动.
解答 解:①实验Ⅱ与实验Ⅰ相比,到达平衡时间缩短,平衡不移动,正反应为气体体积增大反应,应是使用催化剂;
实验Ⅲ与实验I相比,到达平衡时间缩短,反应速率增大,平衡时二氧化氮浓度减小,平衡逆向移动,正反应为气体体积增大的吸热反应,应是升高温度,
故答案为:使用催化剂;升高温度;
②二氧化氮起始浓度为1mol/L,实验I平衡时二氧化氮浓度为0.5mol/L,则:
2NO2(g)?2NO(g)+O2(g)
起始浓度(mol/L):1 0 0
变化浓度(mol/L):0.5 0.5 0.25
平衡浓度(mol/L):0.5 0.5 0.25
故平衡常数K=$\frac{{c}^{2}(NO)×c({O}_{2})}{{c}^{2}(N{O}_{2})}$=$\frac{0.{5}^{2}×0.25}{0.{5}^{2}}$=0.25,
故答案为:0.25;
③恒温恒容下,实验Ⅰ中达平衡后,再向该密闭容器中通入1molNO2与1mol NO混合气体,生成物浓度增大,平衡逆向移动,
故答案为:逆向.
点评 本题考查化学平衡计算与影响因素、平衡常数、化学平衡图象等,(1)中注意利用“先拐先平数值大”原则分析解答.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
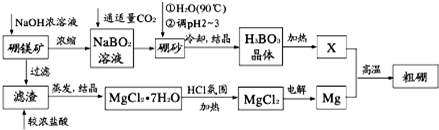
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
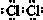 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2NaOH=Na2SiO3+H2O | |
| B. | 苯酚钠溶液中通入少量CO2:2 +CO2+H2O→2 +CO2+H2O→2 +HCO3- +HCO3- | |
| C. | 碳酸氢铵溶液中加入足量热的氢氧化钠溶液:NH4++OH-═NH3↑+H2O | |
| D. | “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用时会放出氯气:ClO-+Cl-+2H+═Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱溶液与小苏打溶液反应:OH-+HCO3-═H2O+CO2↑ | |
| B. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++H2O+CO2 | |
| C. | 向H2O中加入少量Na2O2,产生无色气体:2Na2O2+2H2O═O2↑+4OH-+4Na+ | |
| D. | 向Cl2水中滴入适量FeCl2 溶液,溶液变为黄色:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com