
 �о�����ȿ���CO��CO2��Ӧ�öԹ�����̬������������Ҫ�����壮
�о�����ȿ���CO��CO2��Ӧ�öԹ�����̬������������Ҫ�����壮| �� �� | �� | �� |
| ��Ӧ��Ͷ���� | 1molCO2��3molH2 | a molCO2��b molH2�� c molCH3OH��g����c molH2O��g�� |
���� ��1�������Ȼ�ѧ����ʽ ��˹���ɼ����-�ڡ�3�õ��������жϣ�
��2��COȼ�ϵ���У���������CO����ʧ���ӵ�������Ӧ�������������������õ��ӵĻ�ԭ��Ӧ������Ϊ�������KOH��Һ�������ڵ缫�Ϸų�������̼��
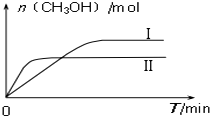
��3���ٸ���ͼ���֪���ߢ�ķ�Ӧ���ʴ����ߢ������ߢ��Ӧ���¶ȸ����ߢ��ߢ��Ӧ�ļ״������ʵ���С��Ҳ����˵�¶ȸ߷�Ӧƽ�������ƶ����ݴ��жϷ�Ӧ�ġ�H�������¶ȶ�ƽ���ƶ���Ӱ���֪�������¶ȣ�ƽ�������ȷ����ƶ����ݴ��ж�ƽ�ⳣ���ı仯��
�ڸ���ƽ���������������ƽ��ʱ����������ʵ�����Ȼ�����ƽ������������ͬ��ֵ����������ȣ�����ʼʱά�ַ�Ӧ����������жϷ�Χ��
�۴ﵽ��Ӧƽ��״̬ʱ����һ�������µĿ��淴Ӧ�����Ӧ���ʺ��淴Ӧ������ȣ���Ӧ������и���ɳɷֵİٷֺ������ֲ��䣬�÷�Ӧ�ʹﵽƽ��״̬���ݴ˷������
��4���ɷ�Ӧ��֪��2CO2��g��+6H2��g��=CH3OCH3��g��+3H2O��g����1mol�����ѷ��Ӿ����绯ѧ�������ɶ�����̼��ˮ�������൱������6mol������������ת��12NA ���ӣ���Ӧǰ�����������С������ѹǿƽ��������У�
��� �⣺��1����Fe2O3��s��+3C��ʯī��=2Fe��s��+3CO��g����H1=+489.0kJmol-1
��C��ʯī��+CO2��g��=2CO��g����H2=+172.5kJmol-1
�ɸ�˹���ɢ�-�ڡ�3�õ�Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-28.5kJmol-1��
�ʴ�Ϊ��Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-28.5kJmol-1��
��2����ȼ�ϵ����KOH��ҺΪ�������Һʱ����������CO����ʧ���ӵ�������Ӧ������Ϊ�������KOH��Һ��������̼���������ط�Ӧ�õ�����̼��أ���CO+4OH--2e-=CO32-+2H2O��
�ʴ�Ϊ��CO+4OH--2e-=CO32-+2H2O��
��3���ٸ���ͼ���֪���ߢ�ķ�Ӧ���ʴ����ߢ������ߢ��Ӧ���¶ȸ����ߢ��ߢ��Ӧ�ļ״������ʵ���С��Ҳ����˵�¶ȸ߷�Ӧƽ�������ƶ����ݴ��жϷ�Ӧ�ġ�H��0�������¶ȶ�ƽ���ƶ���Ӱ���֪�������¶ȣ�ƽ�������ȷ����ƶ������÷�ӦΪ���ȷ�Ӧ�����������¶�ƽ�������ƶ���ƽ�ⳣ����С����K����K����
�ʴ�Ϊ����������
���������̼��Ӧ��Ϊx
CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ����mol����1 3 0 0
ת������mol����x 3x x x
ƽ������mol����1-x 3-3x x x
����ƽ��������ѹǿΪ��ʼʱ��0.8������$\frac{4-2x}{4}$=0.8
���x=0.4mol
�����⣺�ס���Ϊ��ͬƽ�⣬����ʼʱά�ַ�Ӧ������У�����ȫ����������Ͷ�ϣ�c�����ʵ���Ϊ1mol��c �����ʵ������ܵ���ƽ��ʱ�����ʵ���0.4mol������c�����ʵ���Ϊ��0.4��n��c����1mol���ʴ�Ϊ��0.4��n��c����1��
��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����
a����Ӧǰ���������ʵ����仯����������ѹǿ���䣬˵����Ӧ�ﵽƽ��״̬����a��ȷ��
b��H2���������������ƽ���־����b��ȷ��
c������֮�ȵ��ڻ�ѧ����ʽ������֮��Ϊ����Ӧ����֮�ȣ�c��H2��=3c��CH3OH��������˵�����淴Ӧ������ͬ������֤����Ӧ�ﵽƽ��״̬����c����
d����Ӧǰ�������������䣬������䣬�������ܶ�ʼ�ղ��䣬����˵����Ӧ�ﵽƽ��״̬����d����
e��2��C=O���ѵ�ͬʱ��3��C-H�γ�ֻ��˵����Ӧ������У�����˵����Ӧ�ﵽƽ��״̬����d����
�ʴ�Ϊ��a b��
��4���ɷ�Ӧ��֪��2CO2��g��+6H2��g��=CH3OCH3��g��+3H2O��g����1mol�����ѷ��Ӿ����绯ѧ�������ɶ�����̼��ˮ�������൱������6mol������������ת��12NA ���ӣ���Ӧ��g��+4H2��g��?CH3OCH3��g��+H2O��g������Ӧǰ�����������С������ѹǿƽ��������У��÷�Ӧ���������٣�ѹǿ����ʹƽ�����ƣ�CH3OCH3�������ӣ�ѹǿ����ʹCO��H2Ũ�����ӣ���Ӧ�������ʴ�Ϊ��12NA���÷�Ӧ���������٣�ѹǿ����ʹƽ�����ƣ�CH3OCH3�������ӣ�ѹǿ����ʹCO��H2Ũ�����ӣ���Ӧ��������
���� ������Ҫ�������Ȼ�ѧ����ʽ����д���缫��Ӧ����д����ѧƽ����жϺͼ��㼰������ԭ��Ӧ����ʽ����д���ۺ��Խ�ǿ����Ŀ�Ѷ��еȣ�


 ����ѧ��Ӯ�����ϵ�д�
����ѧ��Ӯ�����ϵ�д� ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | һ�ȼ���ĽṹʽCH3C1 | B�� | ���ķ���ʽ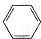 | ||
| C�� | �����ǵĽṹ��ʽC6H12O6 | D�� | ������ӵ����ģ��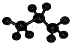 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c��X��/mol/L | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c��Y��/mol/L | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����Ƽ����Ҫԭ����NaCl��CO2��NH3 | |
| B�� | Na2CO3�����ȶ��Ե���NaHCO3 | |
| C�� | �÷����ĸ�������NH4Cl | |
| D�� | ĸҺ��ѭ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� �� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | O |
| 2 | �� | �� | �� | |||||
| 3 | �� | �� | �� | �� | �� | |||
| 4 | �� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ô������ռ� 2KOH+Na2CO3=K2CO3+2NaOH ���ֽⷴӦ | |
| B�� | �ҹ��Ŵ��ġ�ʪ����ͭ����2Fe+3CuSO4=3Cu+Fe2��SO4��3�û���Ӧ | |
| C�� | ����Ȼ����ȼ�� CH4+2O2$\frac{\underline{\;��ȼ\;}}{\;}$CO2+2H2O ������Ӧ | |
| D�� | ֤������þ�Ļ�Ա���ǿ��3Mg+2Fe��OH��3=3Mg��OH��2+2Fe �û���Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com