
| A. | 1471kJ/mol | B. | -1471kJ/mol | C. | 93kJ/mol | D. | -93kJ/mol |
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Al>Mg>Na>H | B. | 热稳定性:NH3>PH3>H2S>HCl | ||
| C. | 元素非金属性:F>O>N>C | D. | 酸性:HClO4>H2SiO3>H3PO4>H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 mol•L-1 | B. | 0.017 mol•L-1 | C. | 0.05 mol•L-1 | D. | 0.50 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | N | P |
| 原子半径/nm | 0.186 | 0.143 | 0.075 | 0.074 | 0.152 | 0.099 |
| 元素的主要化合价 | +1 | +3 | +5、-3 | -2 | +1 | +7、-1 |
| A. | X、N元素的金属性:X>N | |
| B. | Y、M元素形成的离子化合物是工业冶炼Y的原料 | |
| C. | X单质在M单质中燃烧生成的化合物39g中共含有0.5NA个阴离子 | |
| D. | 表中Z元素的最高价氧化物的水化物的分子式可表示为H3ZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物稳定性:HBr>HCl>PH3 | B. | 离子半径:Na+>Cl->F- | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 离子的还原性 Cl>Br>I |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH>7,且c(OH?)>c(K+)>c(H+)>c(CH3COO?) | B. | pH>7,且c(K+)+c(H+)=c(CH3COO?)+c(OH?) | ||
| C. | pH<7,且c(CH3COO?)>c(H+)>c(K+)>c(OH?) | D. | pH=7,且c(CH3COO?)=c(K+)>c(H+)=c(OH?) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
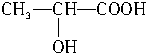
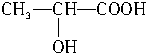 +NaHCO3→
+NaHCO3→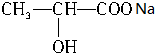 +CO2↑+H2O
+CO2↑+H2O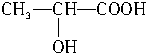 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$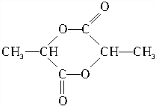 +2H2O.
+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com