
如图所示,将两烧杯用导线相连,Pt、Cu、Zn、C分别为四个电极,闭合开关后,下列叙述正确的是( )
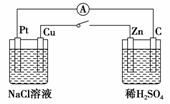
A.C电极为电解池的阳极
B.Cu电极附近OH-浓度增大
C.Na+移向Pt电极
D.Pt电极上有O2生成
科目:高中化学 来源: 题型:
下列除去杂质的方法正确的是( )。
①除去乙烷中少量的乙烯:光照条件下通入Cl2,分离 ②除去乙酸乙酯中的少量乙酸:用饱和碳酸钠溶液洗涤,分液 ③除去硝基苯中混有的浓硝酸和浓硫酸:可向混合物中加入氢氧化钠溶液,分液 ④除去乙醇中的少量乙酸:加足量生石灰,蒸馏
A.①②③ B.①②④
C.②③④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
用如下图所示装置进行下列实验。
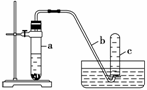
(1)在检查装置气密性后,向试管a中加入10 mL 6 mol·L-1硝酸和1 g Cu片,立即将带有导管的橡皮塞塞紧试管口。请写出在试管a中有可能发生的所有反应的化学方程式
________________________________________________________________________
________________。
(1) 实验过程中反应开始时速率缓慢,随后逐渐加快,这是由于
________________________________________________________________________,
当反应进行一段时间后速率又逐渐减慢,原因是
________________________________________________________________________
________________________________________________________________________。
(3)欲较快地制得NO,可采取的措施是( )
A.加热 B.使用铜粉 C.稀释HNO3 D.改用浓HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
在N2(g)+3H2(g)
 2NH3(g) ΔH<0的平衡体系中,当分离出NH3时,下列说法正确的是( )
2NH3(g) ΔH<0的平衡体系中,当分离出NH3时,下列说法正确的是( )
A.改变条件后速率—时间图象如右图: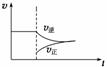
B.此过程中Q>K
C.平衡体系中NH3的含量增大
D.N2的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间3 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
相应的热化学方程式如下:
N2(g)+3H2O(l)===2NH3(g)+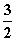 O2(g)
O2(g)
ΔH=765.2 kJ·mol-1
回答下列问题:
(1)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议:
________________________________________________________________________
________________________________________________________________________。
(3)工业合成氨的反应为N2(g)+3H2(g)
 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为 。计算:
。计算:
①该条件下N2的平衡转化率;
②该条件下反应2NH3(g)
 N2(g)+3H2(g)的平衡常数。
N2(g)+3H2(g)的平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO |
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:
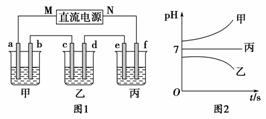
(1)M为直流电源的________极,b电极上发生的电极反应为__________________________________________________________。
(2)计算e电极上生成的气体在标准状况下的体积为________。
(3)写出乙烧杯中的总反应的离子方程式:__________________________________________________________。
(4)要使丙烧杯中的C溶液恢复到原来的状态,需要进行的操作是(写出要加入的物质和质量)____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及其结论都正确的是(双选)( )
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的氧化性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
证明NaHSO3溶液中HSO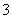 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向盛有1 L 0.1 mol·L-1 NaHSO4溶液的烧杯中不断滴加0.05 mol·L-1的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如下图所示,下列说法不正确的是(双选)( )
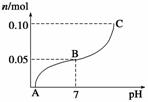
A.A点时pH=1
B.恰好完全沉淀时Ba(OH)2的体积为2 L
C.B点时,溶液中的离子浓度关系为c(Na+)>c(SO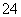 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.C点时pH=14
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com