
【题目】在水溶液中Fe3+和I-存在可逆反应:2Fe3++2I-![]() 2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
A. 反应的平衡常数K=![]()
B. 该可逆反应只能在酸性条件下存在
C. 加入AgNO3,平衡右移,溶液黄色变浅
D. 加入CCl4,平衡右移,水溶液层黄色变浅
【答案】C
【解析】
平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;Fe3+水解显酸性,在碱性条件下Fe3+和Fe2+以氢氧化物沉淀形式存在;碘单质可以与碱反应生成碘离子和碘酸根离子;银离子与碘离子能生成碘化银沉淀;四氯化碳可以从水溶液中把碘单质萃取出来,以此解答。
A、依据平衡常数含义分析可知,该反应的平衡常数K的表达式为K=![]() ,故A正确;
,故A正确;
B、根据氢氧化铁和氢氧化亚铁的Ksp可知,在碱性条件下,二价铁离子和三价铁离子容易生成沉淀,碘单质易与碱反应生成碘离子和碘酸根离子,而且三价铁离子水解显酸性,为抑制水解且防止生成沉淀或发生反应,该反应应在酸性条件下进行,故B正确;
C、加入硝酸银,银离子与碘离子生成碘化银沉淀,导致平衡左移,故C错误;
D、加入CCl4,I2被萃取到CCl4中,平衡右移,Fe3+和I2的浓度都降低,水溶液层黄色变浅,故D正确。
故选C。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】核安全与放射性污染防治已引起广泛关注。在爆炸的核电站周围含有放射性物质 碘-131和钙-137。碘-131 —旦被人体吸入,可能会引发甲状腺肿大等疾病。
(1)与钠同主族的前四周期(包括第四周期)的三种元素X、Y、Z的第一电离能如下表:
元素代号 | X | Y | Z |
第一电离能/(kJ.mol) | 520 | 496 | 419 |
基态Z原子倒数第二层电子的排布式为______。X、Y、Z三种元素形成的单质熔点由高到低的顺序为_______(用元素符号表示),其原因为___________ .
(2)F与I同主族,BeF2分子中心原子的杂化类型为_________ ,BeF2分子是________分子(选填“极性”或“非极性”)。
(3)已知高碘酸有两种形式,化学式分别为H5IO6  和HIO4 ,二者酸性强弱顺序为:H5IO6 ________HIO4(选填">"或"<"“=”)。从电子云的重叠方式的角度分析,H5IO6分子中的化学键有________(写出两种).
和HIO4 ,二者酸性强弱顺序为:H5IO6 ________HIO4(选填">"或"<"“=”)。从电子云的重叠方式的角度分析,H5IO6分子中的化学键有________(写出两种).
(4)131I2晶体的晶胞结构如图甲所示,该晶胞中平均含有________个131I原子,晶体中碘分子的排列有_________种不同的方向。

(5)KI的晶胞结构如图乙所示,每个K+周围紧邻的K+个数为_______个。KI晶体的密度为ρg.cm-3 ,K和I的原子半径分别为rkcm和rI cm,阿伏加德罗常数的值为NA,则 KI晶胞中的空间利用率为_______. [空间利用率=(球体积/晶胞体积)×100%,用相关字母的代数式表示即可]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】各物质间有着一定的转化关系,下列各组物质间可以按下图所示直接转化的是

A.Na→Na2O→Na2CO3→Na2O2B.CO→CO2→H2CO3→CO
C.NaOH→NaCl→Na2CO3→NaOHD.HCl→CuCl2→BaCl2→HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2O4(g)![]() 2NO2(g),将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
2NO2(g),将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
A. 烧瓶内气体的质量不再变化
B. 烧瓶内气体的颜色不再变化
C. 烧瓶内气体的压强不再变化
D. N2O4的消耗速率与NO2的消耗速率之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 化学平衡正向发生移动时,平衡常数K值一定增大
B. HS-的电离方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
C. 由水电离出的c(H+)=1×10-13mol/L的溶液中,可能大量共存的离子:Fe3+、K+、NH4+、 SO42-、Cl-、ClO-
D. AlCl3溶液与Na2CO3溶液混合发生反应:2Al3++3CO32-=Al2(CO3)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
⑴ 铜或铜盐的焰色反应为绿色,该光谱是________(填“吸收光谱”或“发射光谱”)。
⑵ 基态Cu原子中,核外电子占据的最低能层符号是________,其价电子层的电子排布式为___________,Cu与Ag均属于IB族,熔点:Cu________Ag(填“>”或“<”)。
⑶ [Cu(NH3)4]SO4 中阴离子的立体构型是_______;中心原子的轨道杂化类型为_____,[Cu(NH3)4]SO4 中Cu2+与NH3之间形成的化学键称为_______________。
⑷ 用Cu作催化剂可以氧化乙醇生成乙醛,乙醛再被氧化成乙酸,等物质的量的乙醛与乙酸中σ键的数目比为_____________。
⑸氯、铜两种元素的电负性如表:
元素 | Cl | Cu |
电负性 | 3.2 | 1.9 |
CuCl属于________(填“共价”或“离子”)化合物。

⑹Cu 与Cl 形成某种化合物的晶胞如图所示,该晶体的密度为ρ g·cm-3,晶胞边长为a cm,则阿伏加德罗常数为_____(用含ρ、a的代数式表示,相对原子质量:Cu-64,Cl-35.5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将![]() mL 1mo/L
mL 1mo/L ![]() 和
和![]() mL 1mo/L
mL 1mo/L ![]() 两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
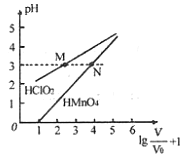
A. ![]() 和
和![]() 均为一元弱酸
均为一元弱酸
B. 在0≤pH≤5时,![]() 溶液满足
溶液满足![]()
C. 分别往M、N两点对应溶液中滴加1 mo/L NaOH溶液至恰好完全反应,消耗NaOH溶液的体积相等
D. 常温下,浓度均为0.1 mo/L的![]() 和
和![]() 溶液,溶液pH:
溶液,溶液pH:![]() >
>![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是![]()
![]()
A. 标准状况下,22.4LCO和CO2的混合物中,含碳原子的数目为NA
B. 14g分子式为C5H10的烃中,含有的碳碳双键的数目为0.2NA
C. 0.1mol/L的CH3COONH4溶液中,含铵根离子数目小于0.1NA
D. 标准状况下2.24LCl2通入足量水中或NaOH溶液中,转移电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
I、甲同学向1molL﹣1氯化铁溶液中加入少量的NaOH溶液;
II、乙同学直接加热饱和FeCl3溶液;
III、丙同学向25ml沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。试回答下列问题:
(1)其中操作正确的同学是___。写出此过程中的化学方程式:___;
(2)证明有Fe(OH)3胶体生成的最简单实验操作是___;
(3)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶粒带__电荷。
②向其中加入饱和Na2SO4溶液,产生的现象是____;
③向所得Fe(OH)3胶体中逐滴滴加硫酸溶液,开始产生红褐色沉淀,这是因为___;继续滴加,沉淀最终消失且得棕黄色溶液,写出化学方程式___;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com