
| ||
| △ |
| 化学键 | H-Cl | O=O | Cl=Cl | H-O |
| 键能/kJ.mol-1 | 431 | 498 | 243 | 463 |
| ||
| △ |
| △C(HCl) |
| △t |


科目:高中化学 来源: 题型:
| A、雾霜空气属于混合物 |
| B、微粒直径为2.5微米的细小颗粒物形成的分散系统能产生丁达尔效应 |
| C、实施绿化工程,实行汽车限行和使用清洁能源可以有效地防治PM2.5污染 |
| D、PM2.5表面积较大,能大量吸附空气中的有毒、有害物质进入人体造成伤害 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钛合金是一种新型金属单质 |
| B、钛合金熔点比成分金属高,且硬度也更大 |
| C、目前人类使用最广泛的金属材料是铝合金 |
| D、青铜、碳素钢、合金钢和硬铝都是合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:
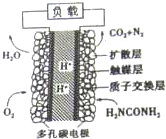 尿液也能发电,尿素燃料电池结构如图所示,用这种电池既能净化含氨废水,又能发电.下列关于该电池描述不正确的是( )
尿液也能发电,尿素燃料电池结构如图所示,用这种电池既能净化含氨废水,又能发电.下列关于该电池描述不正确的是( )| A、电流从左侧电极经过负载后流向右侧电极 |
| B、电池放电时,H+从正极向负极迁移 |
| C、电池的负极反应式:CO(NH2)2+H2O-6e-=N2+CO2+6H+ |
| D、电池降解1mol尿素,理论上消耗标准状况下33.6LO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )| A、X、Y、Z中最简单氢化物稳定性最弱的是X |
| B、氧化物对应水化物的酸性Z一定强于Y |
| C、形成的单核阴离子还原性Y强于X |
| D、Z元素单质在化学反应中只表现氧化性,它在水溶液中有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 成分 | 质量(g) | 摩尔质量(g?mo-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.348 | 174 |
| 阿司匹林 | 0.170 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.020 | 170 |
乙醇 | 9.200 | 46 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该反应能量变化类型与CaCO3分解反应相同 |
| B、加催化剂后,正反应速率加快,逆反应速率减少 |
| C、反应热△H=E2-E1 |
| D、若该反应为氧化还原反应,则可以将其设计成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸的摩尔质量是98 |
| B、1mol氧的质量等于16g |
| C、摩尔是一个基本物理量 |
| D、以克为单位时,12g12C所含的原子数为阿伏伽德罗常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com