
下列实验操作与预期实验目的或所得实验结论不一致的是
选项 | 实验操作 | 实验目的或结论 |
A | 将Al2(SO4)3、NaOH溶液相互滴加 | 鉴别Al2(SO4)3、NaOH溶液 |
B | 向AgCl悬浊液中滴入少量KI溶液,有黄色沉淀生成 | 说明KSP(AgCl)>KSP(AgI) |
C | 向NaHS溶液中滴入酚酞,溶液变红色 | HS-水解程度大于电离程度 |
D | 向某溶液中滴加氯水,再滴加KSCN溶液,溶液变成红色 | 该溶液中一定含有Fe2+ |
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源:2014-2015学年山东省济南市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
原子结构决定元素的性质,下列说法中,正确的是
A.Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小
B.在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的其沸点也一定最高
C.第2周期元素的最高正化合价都等于其原子的最外层电子数
D.非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:简答题
(14分)综合利用CO2、CO对构建低碳社会有重要意义。
(1)Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。700℃时反应的化学方程式为____________。
(2)固体氧化物电解池(SOEC)用于高温共电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。
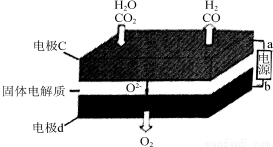
①b为电源的________(填“正极”或“负极”)。
②写出电极c发生的电极反应式:________、________________。
(3)电解生成的合成气在催化剂作用下发生如下反应:CO(g)+2H2(g) CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g),则该反应平衡常数值为_______,此时向容器中再通入0.35 mol CO气体,则此平衡将________(填“向正反应方向”“不”或“向逆反应方向”)移动。
CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g),则该反应平衡常数值为_______,此时向容器中再通入0.35 mol CO气体,则此平衡将________(填“向正反应方向”“不”或“向逆反应方向”)移动。
(4)已知: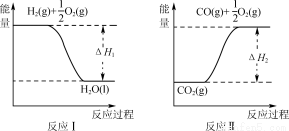
若甲醇的燃烧热为ΔH3,试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g) CH3OH(l)的ΔH,则ΔH=_____。
CH3OH(l)的ΔH,则ΔH=_____。
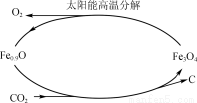
(5)利用太阳能和缺铁氧化物[如Fe0.9O]可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如图所示,若用1 mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成________mol C(碳)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在水溶液中能大量共存的是
A.NH4+、Ag+、CO32—、SO42— B.Fe2+、H+、NO3—、Cl-
C.Al3+、NH4+、HCO3—、Cl- D.K+、Na+、NO3—、SO42—
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通、扬州、连云港高三第二次调研测试化学试卷(解析版) 题型:计算题
(12分)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:

(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是 。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是 。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式: 。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值(写出计算过程)。涉及反应如下(均未配平):
NiOOH+Fe2++H+—Ni2++Fe3++H2O Fe2++MnO4-+H+—Fe3++Mn2++H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通、扬州、连云港高三第二次调研测试化学试卷(解析版) 题型:选择题
国务院颁布的《“十二五”控制温室气体排放工作方案》提出,2015年我国单位国内生产总值CO2排放要比2010年下降17 %。下列说法不正确的是
A.CO2属于酸性氧化物
B.CO2是导致酸雨发生的主要原因
C.可用Na2CO3溶液捕捉(吸收)CO2
D.使用氢能源替代化石燃料可减少CO2排放
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三四月调研考试理综化学试卷(解析版) 题型:填空题
(14分)煤可以通过气化和液化转变为清洁能源并提高燃烧效率。
煤气化的主要反应是:C(g)+ H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
气化得到的CO和H2可以进一步液化合成甲醇,反应方程式为:
CO(g)+2H2(g) CH3OH(g) H
CH3OH(g) H
(1)若相同温度下CO、H2、CH3OH(g)的燃烧热(H)分别为a、b、c,则上述反应的H= 。
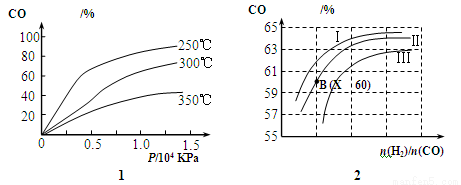
(2)图1表示CO的转化率与温度、压强之间的关系,图2表示CO的转化率与起始投料比n(H2)/n(CO)、温度的变化关系,曲线I、Ⅱ、Ⅲ对应的温度分别为T1、T2、T3,则T1、T2、T3的大小关系为 ,理由 。测得B(X,60)点氢气的转化率为40%,则X= 。
(3)一定条件下,将2 mol CO和4 mol H2置于容积为2 L固定的密闭容器中发生上述反应,反应达到平衡时H2的物质的量为2 mol,则此时CH3OH(g)的物质的量浓度为 ,平衡常数K= 。下列说法中能说明反应已达到平衡状态的是 (填选项前的字母)。
A.混合气体的平均摩尔质量不变
B.一氧化碳的消耗速率等于甲醇的生成速率
C.CO和H2的物质的量之比保持不变
D.混合气体的密度不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市七校高三4月联考化学试卷(解析版) 题型:选择题
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2
C.1L 0.1mol/L该溶液和足量的Zn充分反应,生成11.2 g Fe
D.和Ba(OH)2溶液反应的离子方程式: Fe3++SO42-+Ba2++3OH-===Fe(OH)3↓+BaSO4↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com