

| 实验过程和象限 | 结论 |
| (2)试管A中盛有品红溶液;现象: 品红溶液褪色 | 证明气体中含有SO2 |
| (2)试管B中现象紫色酸性高锰酸钾溶液颜色不变或变浅 ;试管C中现象现象:澄清石灰水变浑浊 | 证明气体中含有CO2 |
| 实验过程 | 实验现象及结论 |
分析 (1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+;
[实验设计]圆底烧瓶中:FeCl 2 溶液、KSCN 溶液,分液漏斗中H2O2 溶液滴入圆底烧瓶中作用,A试管检验二氧化硫,B试管氧化二氧化硫,除去二氧化硫,C试管检验二氧化碳存在,用澄清石灰水,D试管防止倒吸,E吸收尾气.
(2)向 FeSO4溶液中滴加少量KSCN溶液,无明显现象.再滴加 H2O2 溶液时,发现:随着H2O2量的增加,溶液先变红,后褪色,并有气泡产生,气泡可能为二氧化硫,用品红检验;
(3)二氧化碳、二氧化硫都能使澄清石灰水变浑浊,但二氧化硫能被酸性高锰酸钾氧化,该实验可能产生二氧化碳,所以先用酸性高锰酸钾溶液除去二氧化硫,再检验二氧化碳;
(4)根据FeCl2和KSCN混合液中加入少量双氧水的现象分析;
(5)取褪色后的溶液,滴加入适量氯化钡溶液,若有白色沉淀产生,说明含有SO42-,若无白色沉淀产生,说明没有SO42-;
解答 解:(1)FeSO4溶液中滴加双氧水,二者发生氧化还原反应,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
[实验设计]
(2)二氧化硫能使品红褪色,二氧化碳不能,FeSO4溶液中滴加少量KSCN溶液,无明显现象.再滴加 H2O2 溶液时,发现:随着H2O2量的增加,溶液先变红,后褪色,并有气泡产生,气泡可能为二氧化硫、二氧化碳,A试管检验二氧化硫,所以试管A中盛有品红溶液,当品红溶液褪色,证明气体中含有SO2,
故答案为:品红溶液;品红溶液褪色;
(3)二氧化碳、二氧化硫都能使澄清石灰水变浑浊,酸性高锰酸钾溶液与二氧化硫气体发生氧化还原反应,高锰酸钾被还原为硫酸锰,反应为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,所以当紫色酸性高锰酸钾溶液颜色不变或变浅,说明二氧化硫被吸收,二氧化碳能使澄清的石灰水变浑浊,所以试管C中澄清石灰水变浑浊,证明气体中含有CO2,
故答案为:紫色酸性高锰酸钾溶液颜色不变或变浅;澄清石灰水变浑浊;
(4)铁离子和硫氰根离子反应生成络合物为血红色,向FeCl2和KSCN混合液中加入少量双氧水,溶液先变红,说明有三价铁离子存在,说明双氧水优先氧化Fe2+,
故答案为:>;向FeCl2和KSCN混合液中加入少量双氧水,溶液先变红,说明双氧水优先氧化Fe2+;
(5)硫酸根离子和钡离子能形成白色沉淀,所以取烧瓶中褪色后的溶液少许,加盐酸酸化后再滴入几滴BaCl2溶液,溶液变浑浊,说明该反应生成了硫酸根离子,
故答案为:
| 实验过程 | 实验现象及结论 |
| 取烧瓶中褪色后的溶液少许,加盐酸酸化后再滴入几滴BaCl2溶液. | 溶液变浑浊,说明该反应生成了硫酸根离子. |
点评 本题通过探究铁及其化合物性质实验,考查学生对实验原理与实验操作的理解、元素化合物性质的灵活应用等,题目难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 放电时,正极发生的反应是 Pb+SO4+2e═PbSO4 | |
| B. | 放电时,该电池的负极材料是铅板 | |
| C. | 放电时,电池中硫酸的浓度不断变大 | |
| D. | 放电时,每当消耗 1 mol 铅时转移电子 4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
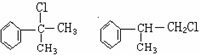
 (X为卤素原子)
(X为卤素原子) 的物质,该物质是一种香料.
的物质,该物质是一种香料.
 ;
;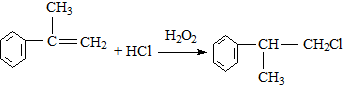 ;
; 的水解产物
的水解产物  ,不能被氧化生成D,若直接转化为D则会降低D的产率与纯度;
,不能被氧化生成D,若直接转化为D则会降低D的产率与纯度; 等任意一种.
等任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥⑦ | B. | ①②④⑤ | C. | ①②⑤⑥ | D. | ③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 含有4molHNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断不正确的是( )
含有4molHNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断不正确的是( )| A. | a是Fe(NO3)3 | B. | n1=1 | C. | p=1.2 | D. | n3=1.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .下列关于苯佐卡因的叙述正确的是( )
.下列关于苯佐卡因的叙述正确的是( )| A. | 分子式为C9H10NO2 | |
| B. | 苯环上有2个取代基,且含有硝基的同分异构体有6种 | |
| C. | 1 mol该化合物最多与4 mol氢气发生加成反应 | |
| D. | 分子中含有3种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钾与水反应:2K+2H2O=2K++2OH-+H2↑ | |
| B. | 铜片放入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| C. | 氯气通入碘化钾溶液中:Cl2+2I-=2Cl-+I2 | |
| D. | 醋酸与碳酸钠溶液反应:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①和③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com