
下列物质中含有原子数由多到少排列正确的是
①0.1molH2SO4 ②4.8g氦气
③5.6L标况下NH3(气体) ④4℃时的5.4 mLH2O(密度为1g·mL-1)
A.①②③④ B.④③②① C.②③④① D.②④③①
科目:高中化学 来源:2015-2016学年甘肃省高二上学期第一次段中考试化学试卷(解析版) 题型:选择题
常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
A.混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L
B.混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+)
C.c(OH-)-c(HY)=c(H+)=1×10-9 mol/L
D.c(Na+)=c(Y-)+c(HY)=0.3 mol/L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄石市高二上学期10月月考化学试卷(解析版) 题型:选择题
下列物质在水溶液中其电离方程式书写正确的是
A.CH3COOH H++CH3COO-
H++CH3COO-
B.NaHSO4 Na++HSO4-
Na++HSO4-
C.H3PO4 3H++PO43-
3H++PO43-
D.NaHCO3 Na++H++CO32-
Na++H++CO32-
查看答案和解析>>
科目:高中化学 来源:2016届浙江省温州市高三上学期返校联考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数,下列叙述正确的是
A.l mol甲基(-CH3)含有9 NA个电子
B.标准状况下,22.4 L SO3含有的原子数为4NA
C.0.10 mol·L-1 NaOH溶液中含有OH-离子数是0.1NA
D.5.6 g Fe与2.24 L Cl2充分反应转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期第一次月考化学试卷(解析版) 题型:填空题
(1)化学反应N2+3H2 = 2NH3的能量变化如图所示,该反应的热化学方程式是:N2(g)+3H2(g) = 2NH3(l);⊿H =
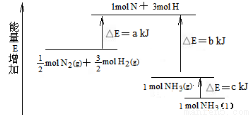
(2)在298K时,1mol C2H6 在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ。写出该反应的热化学方程式 。
(3)已知:反应H2(g) + Cl2(g) = 2HCl(g) ΔH= —184 kJ/mol
4HCl(g)+O2(g) 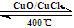 2Cl2(g)+2H2O(g) ΔH= —115.6 kJ/mol
2Cl2(g)+2H2O(g) ΔH= —115.6 kJ/mol

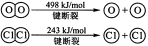
请回答:
H2与O2反应生成气态水的热化学方程式
断开1 mol H—O 键所需能量约为 kJ
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上学期第二次诊断性测试化学试卷(解析版) 题型:计算题
取7.8克的过氧化钠投入水中,完全反应后,所得溶液的体积为1L,问(1)生成的气体体积在标准状态下为多少升?(2)所得溶液溶质的物质的量浓度是多少?(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上学期第二次诊断性测试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.0.1 mol·L-1 Na2S溶液中含有0.2 NA个Na+
B.标准状况下,22.4 L 的H2O含有2NA个氢原子
C.常温下,44 g CO2含有NA个氧原子
D.0.1 mol Na与足量O2反应生成Na2O,转移0.1 NA个电子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期第二次月考化学试卷(解析版) 题型:选择题
有一处于平衡状态的反应:X(s)+3Y(g)  2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A.①③⑤ B.②③⑤ C.②③⑥ D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上学期第一次月考化学试卷(解析版) 题型:填空题
(12分)有科学家正在研究用碳与一氧化氮反应处理环境问题:
C(s)+2NO(g)?CO2(g)+N2(g)△H
(1)实验方案中有下列措施①采用加热提高反应速率②使用催化剂提高反应速率③使用加压提高NO转化率④使CO2转化成干冰从体系用脱离,提高NO的转化率其中你认为可行的是 .(2分)
(2)这个反应的平衡常数表达式是 .(1分)
(3)在恒容恒温密闭容器中,科学家得到下列实验数据:
浓度(mol/L)
时间(min) NO N2 CO2
0 0.100 0 0
10 0.058 0.021 0.021
20 0.040 0.030 0.030
30 0.040 0.030 0.030
请求出该应在该温度下的平衡常数K= .(2分)
(4)若在(3)的实验中30min时开始升温,36min时达平衡,测得NO的转化率变为50%,则该反应的△H 0(1分)(填“>”、“<”、“=”),判断的理由是 .(2分)
(5)若科学家在30min后改变了某一条件,反应进行到40min时达平衡浓度分别为C(NO)=0.032mol/L,C(N2)=0.034mol/L,C(CO2)=0.017mol/L,则改变的条件可能是 ,(2分)判断的依据是 .(2分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com