
【题目】已知aAn+, bB(n+1)+, cCn-, dD(n+1)-是具有相同的电子层结构的短周期元素形成的简单离子,下列叙述正确的是 ( )
A. 原子半径:C>D>A>BB. 原子序数:b>a>c>d
C. 离子半径:Cn->D(n+1)->An+>B(n+1)+D. 单质还原性:A>B>C>D
【答案】B
【解析】
试题aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),原子序数:b>a>c>d,A、B同周期,C、D同周期,且A、B在周期表中C、D的下一周期,四种元素的相对位置:![]() ,则:A.A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,原子核外电子层数越多,原子半径越大,同周期元素原子序数越大,原子半径越小,则有原子半径:A>B>D>C,故A错误;B.aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有原子序数:b>a>c>d,故B正确;C.aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,核电荷数越大离子半径越小,核电荷数b>a>c>d,故离子半径dD(n+1)->cCn->aAn+>bB(n+1),故C错误;D.A、B在周期表中同周期,原子序数:b>a,金属性:A>B,对应单质的还原性:A>B,C、D在周期表同周期,原子序数c>d,非金属性C>D,对应单质的氧化性C>D,所以还原性C<D,故D错误,
,则:A.A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,原子核外电子层数越多,原子半径越大,同周期元素原子序数越大,原子半径越小,则有原子半径:A>B>D>C,故A错误;B.aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有原子序数:b>a>c>d,故B正确;C.aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,核电荷数越大离子半径越小,核电荷数b>a>c>d,故离子半径dD(n+1)->cCn->aAn+>bB(n+1),故C错误;D.A、B在周期表中同周期,原子序数:b>a,金属性:A>B,对应单质的还原性:A>B,C、D在周期表同周期,原子序数c>d,非金属性C>D,对应单质的氧化性C>D,所以还原性C<D,故D错误,
故选B。


科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如图所示:

下列说法不正确的是
A. 酸溶过程使用的酸也可以是硝酸,且过量
B. 为了防止污染,焙烧过程中产生的SO2要回收利用
C. 通氯气的目的是氧化Fe2+
D. 由FeCl3·6H2O制取无水FeCl3需要在氯化氢的气流中加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键的说法中正确的是( )
A. 碘晶体升华和冰熔化时都涉及化学键的变化
B. 氯化钠熔化或氯化氢溶于水时都要破坏化学键
C. 离子化合物中可能含有共价键,共价化合物中可能含有离子键
D. 氯化铵受热变成气体,冷却后又成晶体,此过程中化学键没有发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家游泳中心(水立方)的建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成聚全氟乙丙烯,下列说法错误的是( )
A. ETFE分子中可能存在“﹣CH2﹣CH2﹣CF2﹣CF2﹣”的连接方式
B. 聚全氟乙丙烯分子的结构简式可能为![]()
C. 四氟乙烯分子中含有极性键和非极性键,六氟丙烯中所有原子不可能共平面
D. 合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乳酸(PLA),是一种无毒性、可再生、可分解的高分子聚合物塑料,PLA早期是开发在医学上使用,作手术缝合线及骨钉等,现在则已较广泛的应用于一些常见的物品,如:包装袋、纺织纤维,PLA由植物中萃取出淀粉(玉米、甜菜、小麦、甘薯等)或用纤维素(玉米干草、麦杆、甘蔗渣等木质的农业废弃物)经过下列过程制造而成:
淀粉或纤维素![]() 葡萄糖
葡萄糖![]() 乳酸
乳酸![]() 聚乳酸
聚乳酸
根据上述信息,回答下列问题:
(1)淀粉水解生成葡萄糖的化学方程式为_________;
(2)已知1mol葡萄糖![]() 2mol乳酸,转化过程中无其它反应物、生成物,则乳酸的分子式为_________;
2mol乳酸,转化过程中无其它反应物、生成物,则乳酸的分子式为_________;
(3)某研究性小组为了研究乳酸(无色液体,与水混溶)的性质,做了如下实验:
①取1.8g乳酸与过量的饱和NaHCO3溶液反应,测得生成的气体体积为448mL(气体体积已换算为标准状况下体积);
②另取1.8g乳酸与过量的金属钠反应,测得生成的气体体积为448mL(气体体积已换算为标准状况下体积)。
由实验数据推知乳酸分子含有_________(填官能团名称),从以上条件推知乳酸的结构简式可能为_________;
(4)经现代化学仪器分析,测定乳酸分子中含有一个甲基.请写出乳酸分子之间通过酯化反应生成的六元环状化合物的结构简式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用25%的稀H2SO4溶液与铁块反应制取氢气,下列措施能加快反应速率的是
A. 适当降低温度
B. 将铁块改为铁粉
C. 将所用硫酸改为98.3%浓硫酸
D. 滴加少量氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A. 0.1mol FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
B. 常温下,78 g Na2O2中含有的阴离子数是2NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. pH=1的H2SO4溶液中,含有H+的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 电解精炼铜时,粗铜与直流电源的负极相连
B. 镀层破损后,镀锡铁片中铁比镀锌铁片中铁耐腐蚀
C. 常温时,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液pH=7
D. 合成氨反应N2(g) + 3H2(g)![]() 2NH3(g),当2v(N2)正 = v(NH3)逆时,反应达到平衡
2NH3(g),当2v(N2)正 = v(NH3)逆时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示。C为常见的调味品,D是常见的无色液体。E、F、H和J均为气体,其中H和J为单质,且两者在一定条件下可生成E。
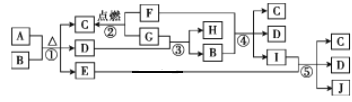
(1)物质的性质决定物质的用途。物质I的溶液可用作家用消毒剂、漂白液,是因为物质I具有__性。
(2)写出反应①的化学方程式:_____。
(3)写出反应③的化学方程式,并用单线桥表示电子转移的方向和数目:___。
(4)写出反应④的离子方程式:____。
(5)写出反应⑤的化学方程式:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com