
| A. |  分散系的分类 | B. | 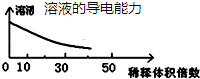 稀释浓硫酸的过程 | ||
| C. | 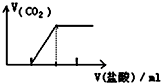 向碳酸钠溶液中逐滴滴入盐酸 | D. | 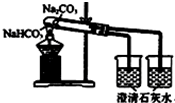 比较Na2CO3、NaHCO3的稳定性 |
分析 A.依据分散系的本质区别是分散质微粒直径的大小判断;
B.浓硫酸不导电;
C.碳酸钠与盐酸先反应生成碳酸氢钠,碳酸氢钠再与盐酸反应生成二氧化碳;
D.要验证碳酸氢钠稳定性弱于碳酸钠,应将碳酸氢钠放在内管;
解答 解:A.胶体分散质粒子直径在1到100纳米之间,溶液分散质粒子直径小于1纳米,浊液分散质粒子直径大于100纳米,故A错误;
B.浓硫酸不导电,稀释过程中导电能力先增大后较小,故B错误;
C.向Na2CO3溶液中逐滴滴加盐酸先后发生Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,开始无气体,后来才产生气体,且前后所加盐酸的体积比为1:1,故C正确;
D.要验证碳酸氢钠稳定性弱于碳酸钠,应将碳酸氢钠放在内管,故D错误;
故选:ABD.
点评 本题考查了常见分散系的特征、物质反应的反应先后顺序,影响电解质导电能力原因,明确分散系分类依据、物质的性质是解题关键,题目难度不大.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| B. | 工业上以氯气和石灰乳为原料制备漂白粉 | |
| C. | 单质硅常用做光导纤维的材料,这与硅的半导体性能有一定关系 | |
| D. | 高压钠灯发出的黄光射程远、透雾能力强,常用做路灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
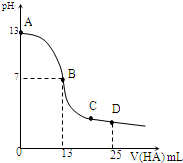 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol的氨气与1mol的铵根离子所含电子数、质子数均为10NA | |
| B. | 14g乙烯和14g聚乙烯所含的原子数均为3NA | |
| C. | 标准状况下,11.2LCH3CH20H中含有的C-H键的个数为2.5NA | |
| D. | 1L1mol•L-1的NaAl02溶液中含有Al02-的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、CO32-、NO3- | ||
| C. | K+、NH4+、MnO4-、SO42- | D. | Na+、K+、NO3-、HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
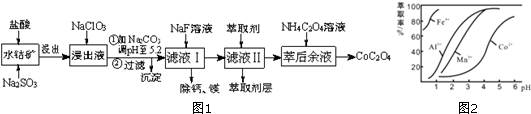
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com