
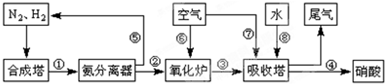
|
合成氨工业采用铁作催化剂,这是因为 | |
| [ ] | |
A. |
能提高H2的转化率 |
B. |
能提高平衡时NH3的百分含量 |
C. |
提高N2的利用率 |
D. |
能加快反应速率 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
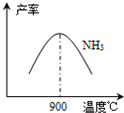 (3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因
| ||
| △ |
| ||
| △ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高二版(选修4) 2009-2010学年 第13期 总第169期 人教课标版(选修4) 题型:043
解释化学平衡
对于合成氨工业,采用的适宜条件是:
(1)增大氢气、氮气浓度,及时将氨分离出来;(2)温度为500℃的高温;(3)压强为20 MPa~50 MPa;(4)使用铁作催化剂.查看答案和解析>>
科目:高中化学 来源:2012年苏教版高中化学选修2 2.1氨的合成练习卷(解析版) 题型:选择题
合成氨工业采用铁触媒作催化剂,这是因为( )
A.能提高H2的转化率
B.能提高平衡时NH3的百分含量
C.能提高N2的利用率
D.能加快反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com