
【题目】硫在自然界中以游离态和多种化合态形式出现,硫的化合物大多具有氧化性或还原性,许多金属硫化物难溶于水。完成下列填空:
【1】硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式____________。
【2】向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象。____
【3】为了使Na2S溶液中![]() 的比值变小,可适量加入(或通入)的物质是_______。
的比值变小,可适量加入(或通入)的物质是_______。
a.H2S气体 b.NaOH固体 c.HCl气体 d.KOH固体
向Na2S固体中分别加入浓硫酸和稀硫酸,所得产物____________(填“相同”或“不同”),由此可知硫酸氧化性的强弱与______________有关。
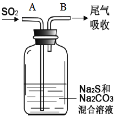
【4】在如图中,从A管通入一定量SO2后,在B处检测到有新的气体生成。B处排出的气体中(填“含”或“不含”)________ H2S,原因是__________。
【5】常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
温度(℃) | c(氨水)(mol/L) | 电离程度(%) | c(OH-)(mol/L) |
0 | 16.56 | 9.098 | 1.507×10-2 |
10 | 15.16 | 10.18 | 1.543×10-2 |
20 | 13.63 | 11.2 | 1.527×10-2 |
表中c(OH-)基本不变的原因是________。
【答案】
【1】3H2SO4+5H2S+2KMnO4→5S↓+2MnSO4+K2SO4+8H2O
【2】饱和H2S溶液中电离产生的S2-很少,因此没有沉淀,加入氨水后,促进H2S的电离,S2-浓度增大,有沉淀生成
【3】 d 不同 浓度
【4】 不含 H2S会与SO2反应,生成S沉淀
【5】氨水浓度降低,使c(OH-)减小,而温度升高,使c(OH-)增大,双重作用使c(OH-)基本不变
【解析】
1.在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,书写化学方程式时,由于不能确定硫酸在反应物还是生成物中出现,所以最后配平时再考虑。
2.向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,说明c(S2-)小,继续滴加一定量的氨水后,生成ZnS沉淀,说明平衡移动后,使c(S2-)增大。
3.为了使Na2S溶液中![]() 的比值变小,可适量加入(或通入)的物质,要么直接加入S2-,要么设法抑制S2-的水解。
的比值变小,可适量加入(或通入)的物质,要么直接加入S2-,要么设法抑制S2-的水解。
向Na2S固体中分别加入浓硫酸时,发生氧化还原反应,加入稀硫酸时,发生复分解反应,由此可确定反应产物及硫酸表现性质的异同。
4.在如图中,从A管通入一定量SO2后,SO2与H2S的氧化还原反应先进行,SO2与Na2CO3的非氧化还原反应后发生。
5.对于弱电解质的电离,浓度小,电离程度大,温度高,电离程度大;所以,分析c(OH-),也应从两个方面考虑。
【1】在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,书写化学方程式时,先按电子守恒配平5H2S+2KMnO4→5S↓+2MnSO4,再按质量守恒配平得方程式3H2SO4+5H2S+2KMnO4→5S↓+2MnSO4+K2SO4+8H2O。答案为:3H2SO4+5H2S+2KMnO4→5S↓+2MnSO4+K2SO4+8H2O;
【2】向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,说明c(S2-)小,继续滴加一定量的氨水后,生成ZnS沉淀,说明平衡移动后,使c(S2-)增大。用电离平衡原理解释为:饱和H2S溶液中电离产生的S2-很少,因此没有沉淀,加入氨水后,促进H2S的电离,S2-浓度增大,有沉淀生成。答案为:饱和H2S溶液中电离产生的S2-很少,因此没有沉淀,加入氨水后,促进H2S的电离,S2-浓度增大,有沉淀生成;
【3】为了使Na2S溶液中![]() 的比值变小,可适量加入(或通入)的物质,要么直接加入S2-,要么设法抑制S2-的水解。
的比值变小,可适量加入(或通入)的物质,要么直接加入S2-,要么设法抑制S2-的水解。
a.通入H2S气体,发生反应S2-+H2S=2HS-,c(S2-)减小,![]() 增大,a不合题意;
增大,a不合题意;
b.加入NaOH固体,虽然抑制S2-水解,增大c(S2-),但同时加入Na+,c(Na+)增大更多,所以![]() 增大,b不合题意;
增大,b不合题意;
c.通入HCl气体,发生反应S2-+2H+=H2S↑,c(S2-)减小,![]() 增大,c不合题意;
增大,c不合题意;
d.加入KOH固体,抑制S2-水解,c(S2-)增大,![]() 减小,d符合题意;
减小,d符合题意;
故选d。
向Na2S固体中分别加入浓硫酸时,发生氧化还原反应,加入稀硫酸时,发生复分解反应,所得产物不同,由此可知硫酸氧化性的强弱与浓度有关。
答案为:d;不同;浓度;
【4】4.从A管通入一定量SO2后,发生反应:3SO2+2Na2S=2Na2SO3+3S↓,SO2+Na2CO3=Na2SO3+CO2,所以B处排出的气体中不含 H2S,原因是H2S会与SO2反应,生成S沉淀。答案为:不含;H2S会与SO2反应,生成S沉淀;
【5】对于弱电解质的电离,浓度小,c(OH-)小,温度高,电离程度大,c(OH-)大。由此得出表中c(OH-)基本不变的原因是氨水浓度降低,使c(OH-)减小,而温度升高,使c(OH-)增大,双重作用使c(OH-)基本不变。答案为:氨水浓度降低,使c(OH-)减小,而温度升高,使c(OH-)增大,双重作用使c(OH-)基本不变。
往Na2S溶液中加入NaOH固体,由于我们的注意力主要集中在OH-的加入,抑制S2-的水解,从而导致c(S2-)增大,很容易得出结论:![]() 增大,所以,在解题时,应先看加入后,直接引起的浓度变化,然后再看对平衡的影响。
增大,所以,在解题时,应先看加入后,直接引起的浓度变化,然后再看对平衡的影响。


科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种工业盐,实验室可用如下装置(略去部分夹持仪器)制备。
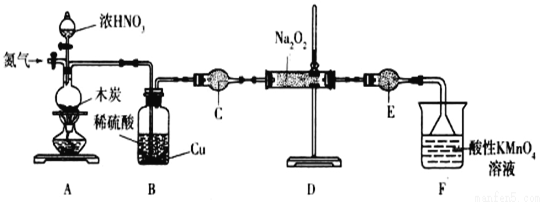
已知:①2NO+Na2O2=2NaNO2; ②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间N2,目的是_______________。
(2)装置A中发生反应的化学方程式为__________________________________。实验结束后,将B瓶中的溶液经蒸发浓缩、__________(填操作名称)、过滤可获得CuSO4·5H2O。
(3)仪器C的名称为______________,其中盛放的药品为 ____________(填名称)。
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,________________,则产物是NaNO2(注明试剂、现象)。
(5)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:

①第一组实验数据出现异常,造成这种异常的原因可能是_________(填代号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②根据表中数据,计算所得固体中亚硝酸钠的质量分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有下列离子中的几种(不考虑溶液中含的较少的H+和OH-)Na+、NH4+、SO42-、CO32-、NO3-。取200mL该溶液,分为等体积的二份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL。实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33克。下列说法正确的是( )
A.该溶液中不一定含有Na+
B.该溶液中肯定含有NH4+、SO42-、CO32-、NO3-
C.该溶液中一定不含NO3-
D.该溶液中一定含Na+,且c(Na+)≥0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
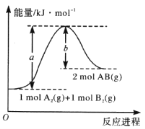
A. 每生成2 mol AB吸收bkJ热量
B. 该反应热△H= + (a-b)kJ mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,只能表示一个化学反应的是( )
①Fe+Cu2+=Fe2++Cu
②Ba2++2OH-+2H++SO42—=BaSO4↓+2H2O
③Cl2+H2O![]() H++Cl—+HClO
H++Cl—+HClO
④CO32-+2H+=CO2↑+H2O
⑤Ag++Cl-= AgCl↓
A.①②③④⑤B.①②③C.②③D.③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,各物质的浓度随时间的变化如图1所示,请回答下列问题:
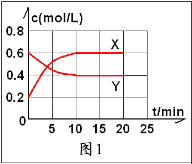
(1)图1中,曲线_______(填“X”或“Y”)表示NO2浓度随时间的变化情况,前10min内v(NO2)=_______mol/(L· min);
(2)下列选项中不能说明该反应已达到平衡状态的是____(填选项字母)
A. 容器内混合气体的压强不随时间变化而改变
B. 容器内混合气体的密度不随时间变化而改变
C. 容器内混合气体的颜色不随时间变化而改变
D. 容器内混合气体的平均相对分子质量不随时间变化而改变
(3)反应进行到10min时,共吸收热量22.76kJ,则该反应的热化学反应方程式为______________________,该反应的平衡常数K=_____________;
(4)反应进行到20min时,再向容器内充入一定量的NO2,10min后达到新平衡,此时测得c(NO2)=0.9mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中的NO2的体积分数为w2,则w1______w2(填“>”“=”或“<”)
②请在图2中画出20min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”,且要体现出始状态与末状态要用具体浓度)________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
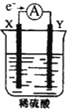
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g) + I2(?)![]() 2HI(g)+9.48kJ
2HI(g)+9.48kJ
②H2(g) + I2(?)![]() 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是
A.①中的I2为固态,②中的I2为气态
B.②的反应物总能量比①的反应物总能量低
C.①的产物比反应②的产物热稳定性更好
D.1mol 固态碘升华时将吸热17kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com