
| A. | 1.0×l0-15 | B. | 1.0×10-14 | C. | 1.0×10-13 | D. | l.0×l0-7 |
分析 在硫酸溶液中,水的电离被抑制,溶液中的氢离子几乎全部来自于硫酸的电离,而氢氧根全部来自于水的电离;在硫酸铝溶液中,氢离子和氢氧根全部来自于水的电离,而由于铝离子的水解,故溶液中的氢离子浓度是水电离出的全部氢离子,即在硫酸铝溶液中,水电离出的氢离子即是溶液中的全部氢离子.
设两溶液的pH=a,则在硫酸和硫酸铝溶液中,c(H+)=10-amol/L,而对于硫酸铝来说,c(H+)=10-amol/L全部由水电离出,即c(H+)=10-amol/L=1.0×10-3 mol/L,故可得a=3.据此分析.
解答 解:在硫酸溶液中,水的电离被抑制,溶液中的氢离子几乎全部来自于硫酸的电离,而氢氧根全部来自于水的电离;在硫酸铝溶液中,氢离子和氢氧根全部来自于水的电离,而由于铝离子的水解,故溶液中的氢离子浓度是水电离出的全部氢离子,即在硫酸铝溶液中,水电离出的氢离子即是溶液中的全部氢离子.
设两溶液的pH=a,则在硫酸和硫酸铝溶液中,c(H+)=10-amol/L,而对于硫酸铝来说,c(H+)=10-amol/L全部由水电离出,即c(H+)=10-amol/L=1.0×10-3 mol/L,故可得a=3.
而在硫酸溶液中,c(OH-)等于水电离出的c(H+)=l.0×l0-10mol/L,而溶液中的c(H+)=10-amol/L=1.0×10-3 mol/L,故此温度下,水的离子积Kw=1.0×10-3 mol/L×l.0×l0-10mol/L=l.0×l0-13,
故选C.
点评 本题考查了酸和能水解的盐溶液中的pH的有关计算,难度较大,应注意公式的运用和酸对水的电离的抑制以及盐对水的电离的促进.


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,电池正极上发生的反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O | |
| B. | 充电时,Pb应相连直流电源的正极 | |
| C. | 放电时,负极质量每增重9.6g,溶液中就消耗0.4molH+ | |
| D. | 需要定期补充硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
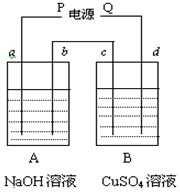 按如图装置实验,a、b、c、d均为惰性电极,A、B两烧杯中分别盛放NaOH溶液和足量CuSO4溶液.通电一段时间后,c电极质量增加6.4g,试回答:
按如图装置实验,a、b、c、d均为惰性电极,A、B两烧杯中分别盛放NaOH溶液和足量CuSO4溶液.通电一段时间后,c电极质量增加6.4g,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 出现环境 | 实验事实 | |
| A | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
| B | 电解CuCl2溶液 | 电子经过负极→阴极$\stackrel{通过电解液}{→}$阳极→正极 |
| C | 弱酸性环境下钢铁腐蚀 | 负极处产生H2,正极处吸收O2 |
| D | 将钢闸门与外加电源负极相连 | 牺牲阳极阴极保护法,可防止钢闸门腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
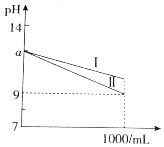
| A. | 曲线Ⅰ表示NaOH溶液中pH的变化 | |
| B. | 开始时两溶液中水的电离程度相同 | |
| C. | 由图象可知,开始时c(NaOH)=0.01mol•L-1 | |
| D. | 在稀释过程中氨水溶液中的$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②④ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 | |
| B. | 氢氟酸保存在细口玻璃瓶中 | |
| C. | 高纯度的硅单质广泛用于制作光导纤维 | |
| D. | 大量燃烧化石燃料排放的废气中含CO2、SO2,从而使雨水的pH=5.6形成酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去).
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com