
【题目】已知图一表示的是可逆反应 CO(g)+H2(g)![]() C(s)+H2O(g)-Q(Q>0)的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g)-Q(Q>0)的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)![]() N2O4(g)+Q(Q>0)的浓度(c)随时间 t 的变化情况,下列 说法中正确的是
N2O4(g)+Q(Q>0)的浓度(c)随时间 t 的变化情况,下列 说法中正确的是
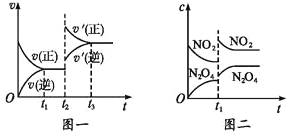
A.图一 t2 时刻改变的条件可能是升高了温度或增大了压强
B.图一 t2 时刻改变的条件可能是通入了 CO 气体
C.图二 t1 时刻改变的条件可能是升高了温度或增大了压强
D.图二 t1 时刻改变的条件是增大压强,则混合气体的平均相对分子质量将减小
【答案】A
【解析】
A. 该反应的正反应是吸热反应,图一中升高温度正逆反应速率都增大,平衡正向移动,改变条件瞬间正逆反应速率与原来平衡速率没有接触点,图象符合,故A正确;
B. 图一中通入CO气体瞬间,反应物浓度增大,生成物浓度不变,则改变条件瞬间正反应速率增大,逆反应速率不变,与原来平衡速率应该有接触点,图象不符合,故B错误;
C. 该反应的正反应是放热反应,图二中升高温度瞬间反应物和生成物浓度不变,则升高温度瞬间反应物和生成物浓度都不变,图象不符合,故C错误;
D. 图二中如果改变的条件是增大压强,容器体积减小,反应物和生成物浓度都增大,平衡正向移动,导致反应物浓度减小、生成物浓度增大,混合气体总物质的量减小,气体总质量不变,其平均摩尔质量增大,摩尔质量在数值上等于其相对分子质量,所以改变条件后气体平均相对分子质量增大,故D错误;
答案选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。某课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用如图装置来测定过氧化钠的质量分数。
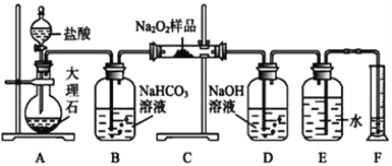
①将仪器连接好以后,必须进行的第一步操作是_____。
②B装置出来的气体是否需要干燥______(填“是”或“否”)。
③D中NaOH溶液的作用_________。
④实验结束时,读取实验中生成气体的体积时,不合理的是_____。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为____。
⑥实验完成后E到F之间导管内残留水的体积会使测量结果________(填“偏大”“偏小”或“不影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可代替的。
Ⅰ.现有以下物质:①H2O ②Cu ③BaCO3 ④Fe(OH)3胶体 ⑤酒精 ⑥CO2 ⑦稀硫酸
(1)以上物质中属于混合物的是________(填序号,下同),属于电解质的是________。
(2)向④中逐滴滴加⑦,可观察到的现象是_____________________。
Ⅱ.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(3)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是________(填字母)。
![]()
(4)有同学认为所有酸碱中和反应均可表示为H++OH-=H2O。请举个例子反驳上述观点(用离子方程式表示)_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合如图判断,下列说法正确的是()

A.装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-=Fe2+
B.装置Ⅰ中正极反应是O2+2H2O+4e-=4OH-
C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动
D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH分别增大和减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。
(1)该同学应选择________mL的容量瓶。
(2)其操作步骤如下图所示,
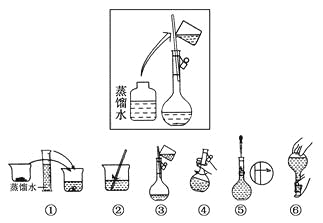
则如图操作应在下图中的________(填选项字母)之间。
A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。
附表 砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
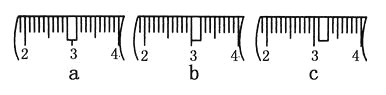
(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏大”、“偏小”或“无影响”,下同)
②容量瓶中原来有少量蒸馏水,浓度会________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l),现用如图1装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g。请回答下列问题:
2PbSO4(s)+2H2O(l),现用如图1装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g。请回答下列问题:
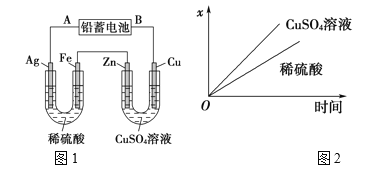
(1)A是铅蓄电池的________极,铅蓄电池正极反应式为:______。
(2)Ag电极的电极反应式是______,该电极的电极产物共________g。
(3)Cu电极的电极反应式是________,CuSO4溶液的浓度_______(填“减小”“增大”或“不变”)。
(4)如图2表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示_______。
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)表中元素原子半径最大的是(写元素符号)___,Y原子的电子排布式是__,Z原子核外电子能量最高的电子亚层是___。
(2)下列事实能说明Y元素的非金属性比S元素强的是___;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y单质比1mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)CCl4是一种常见的有机溶剂,写出其电子式___,判断其属于含有___(填“极性”、“非极性”)共价键的____分子(填“极性”或“非极性”)。SiH4的沸点比CH4高,原因是___。
(4)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式说明产生该现象的原因:___,在上述红色的溶液中加入少许氯化钙固体,溶液颜色变浅,请用平衡理论解释产生该现象的原因____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有0.5L某泉水样品,其中含有Ca2+0.02g,请计算:
(1)该泉水样品中Ca2+的物质的量浓度是多少___?
(2)为使该泉水样品中所含的Ca2+全部沉淀,至少应加入Na2CO3的物质的量是多少___?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1molL﹣1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
A. 将溶液稀释到原体积的2倍B. 加入适量的醋酸钠固体
C. 加入等体积0.2 molL﹣1盐酸D. 加少量冰醋酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com