
 2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品.
2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品.| 物质 | Cl2 | TiCl4 | O2 |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
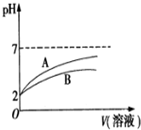
分析 (1)NaCN溶液中CN-离子水解,溶液显碱性;25℃时,HCN的电离常数Ka=6.2×10-10 mol•L-1;CH3COOH的电离常数Ka=1.7×10-5 mol•L-1,都是弱酸说明醋酸酸性大于氰酸,酸越弱对应盐的水解程度越大,溶液碱性越大;
(2)200℃固体硝酸铵可以分解为N2O和H2O,书写化学方程式为NH4NO3=N2O+2H2O,反应中氮元素化合价-3价和+5价变化为+1价,电子转移总数为4e-,此过程中每转移电子8mol放出热量84.8kJ,则转移4mol电子放出热量42.4KJ,标注物质聚集状态和对应反应焓变得到热化学方程式;
(3)①计算t时刻浓度商Qc和平衡常数K比较平淡反应进行的方向;
②依据三段式列式计算起始量,结合平衡常数计算消耗浓度,用反应速率概念计算氯气的反应速率;反应是气体体积不变的吸热反应,依据化学平衡移动原理和平衡影响因素分析选项判断平衡正向进行的条件;
解答 解:(1)NaCN溶液中CN-离子水解,溶液显碱性,溶液中离子浓度大小为:c(Na+)>c(CN-)>c(OH-)>c(H+);25℃时,HCN的电离常数Ka=6.2×10-10 mol•L-1;CH3COOH的电离常数Ka=1.7×10-5 mol•L-1,都是弱酸说明醋酸酸性大于氰酸,稀释相同倍数,酸性弱的溶液PH变化小,则HCN溶液PH变化小,A为醋酸变化曲线,酸越弱对应盐水解程度越大,相同条件下同浓度的NaCN溶液的pH大于CH3COONa溶液的pH,
故答案为:c(Na+)>c(CN-)>c(OH-)>c(H+);A;>;
(2)200℃固体硝酸铵可以分解为N2O和H2O,化学方程式为NH4NO3=N2O+2H2O,反应中氮元素化合价-3价和+5价变化为+1价,电子转移总数为4e-,此过程中每转移电子8mol放出热量84.8kJ,则转移4mol电子放出热量42.4KJ,标注物质聚集状态和对应反应焓变得到热化学方程式为:NH4NO3(s)=N2O(g)+2H2O(g)△H=-42.4 kJ•mol-1,
故答案为:NH4NO3(s)=N2O(g)+2H2O(g)△H=-42.4 kJ•mol-1;
(3)①TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g);△H>0.此温度下,该反应的平衡常数为400,反应到t时刻测得各组分的浓度计算浓度商Qc=$\frac{0.6×0.6}{0.4{4}^{2}}$=1.86<K=400,则反应正向进行,
故答案为:正;
②TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)
起始量(mol/L) 1.64 0 0
变化量(mol/L) 1.2 0.6 0.6
t时刻量(mol/L) 0.44 0.6 0.6
若经10min反应达到平衡,设平衡消耗氯气浓度x,
TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)
起始量(mol/L) 1.64 0 0
变化量(mol/L) x 0.5x 0.5x
t时刻量(mol/L) 1.64-x 0.5x 0.5x
$\frac{0.5x×0.5x}{(0.56-x)^{2}}$=400
x=1.6mol/L,
该时间内反应速率v(Cl2)=$\frac{1.6mol/L}{10min}$=0.16mol/L•min,
a.使用催化剂改变化学反应速率不改变化学平衡,故a错误;
b.反应前后气体不变,增大压强平衡不变,故b错误;
c.反应前后气体不变,减小压强平衡不变,故c错误;
d. 反应是吸热反应,升高温度,平衡正向进行,故d正确;
故答案为:0.16;d;
点评 本题考查了盐类水解、弱电解质电离平衡影响因素分析、热化学方程式、化学平衡的计算和反应方向的计算应用,主要是影响化学平衡的因素的理解应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Cl2与H2O反应:Cl2+H2O═2H++ClO-+Cl- | |
| B. | 往FeCl3溶液中加入Cu粉:Fe3++Cu═Fe2++Cu2+ | |
| C. | 向AlCl3溶液中滴加氨水至过量:Al3++3OH-═Al(OH)3↓ | |
| D. | 将铜片投入浓硝酸中:2NO3-+Cu+4H+═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成0.1 mol O2转移0.4mol电子 | |
| B. | 相同条件下足量Na2O2吸收10LCO2放出5LCO2 | |
| C. | 氧化剂是Na2O2,还原剂是CO2 | |
| D. | 在Na2O2+SO2═Na2SO4的反应中,SO2的作用跟CO2相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3溶液中滴入少量的Na2S溶液 2Ag NO3+S2-=Ag2S↓+2NO3- | |
| B. | 过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O=HCO3-+HClO | |
| C. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O | |
| D. | 向Ba(OH)2溶液中加入少量NaHCO3溶液 2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C分别与D形成的化合物的热稳定性依次减弱 | |
| B. | B、D原子构成的一种分子B2D4只含有极性共价单键 | |
| C. | B、C、D三种元素可以形成酸、碱或者盐三种物质 | |
| D. | C的离子半径小于E的离子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水、Cu(OH)2 | B. | FeCl3溶液、金属钠、溴水、石蕊试液 | ||
| C. | 石蕊试液、溴水 | D. | KMnO4酸性溶液、石蕊试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、K+、Na+、SO42- | B. | Na+、H+、OH-、Cl- | ||
| C. | Mg2+、K+、Cl-、NO3- | D. | Ca2+、K+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加稀盐酸产生无色气体,将气体通过澄清石灰水中,溶液变浊,一定有SO32- | |
| B. | 加氯化钡溶液有白色沉淀产生,再加盐酸沉淀不消失,一定有SO42- | |
| C. | 加氢氧化钠并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 某溶液焰色反应为黄色,则待测液中一定不含钾元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com