
| A. | 吸收y mol H2只需1 mol MHx | |
| B. | 平衡时容器内气体压强减小 | |
| C. | 若降温,该反应的平衡常数增大 | |
| D. | 若向容器内通入少量氢气,则v(放氢)>v(吸氢) |
分析 A.为可逆反应,1molMHx(s)与ymolH2(g)不能完全反应;
B.恒温恒容的密闭容器中,气体的物质的量与压强成正比;
C.反应为放热,反应升高温度,平衡正向移动;
D.通入少量氢气,平衡正向移动.
解答 解:A.为可逆反应,1molMHx(s)与ymolH2(g)不能完全反应,则吸收y mol H2需大于1 mol MHx,故A错误;
B.恒温恒容的密闭容器中,气体的物质的量与压强成正比,储氢时气体的物质的量减小,则平衡时容器内气体压强减小,故B正确;
C.反应为放热,反应降低温度,平衡正向移动,则该反应的平衡常数增大,故C正确;
D.通入少量氢气,平衡正向移动,则v(放氢)<v(吸氢),故D错误;
故选BC.
点评 本题考查化学平衡移动,为高频考点,把握化学平衡移动的影响因素为解答的关键,侧重分析与应用能力的考查,注意K与温度的关系,选项B为易错点,题目难度不大.


科目:高中化学 来源: 题型:实验题
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
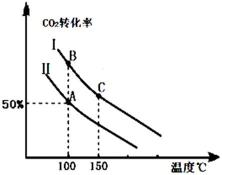
 分析图象回答:曲线②NO转化率随温度升高而增大的原因反应没有达到平衡,温度越高反应速率越快,转化率越大.在图2中画出反应2NO(g)+2CO(g)?N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.
分析图象回答:曲线②NO转化率随温度升高而增大的原因反应没有达到平衡,温度越高反应速率越快,转化率越大.在图2中画出反应2NO(g)+2CO(g)?N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该条件下,反应前后的压强之比为6:5.3 | |
| B. | 若反应开始时容器体积为2 L,则0~2 min内v(SO3)=0.35 mol/(L•min) | |
| C. | 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol | |
| D. | 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出的热量大于Q kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
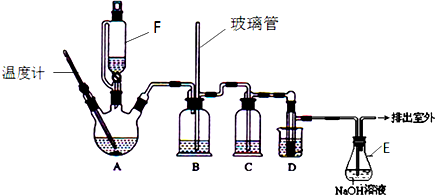
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
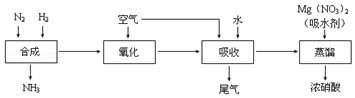
 1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.
1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新割FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+=Fe3++NO2↑+H2O |
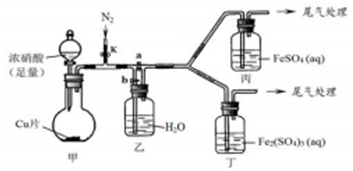
| 步骤 | 操作及现象 | 解释或结论 |
| ① | 关闭k、b,打开a,开始甲中反应,一段时间后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化 | 溶液深棕色由Fe2+与NO或NO2反应而的得到 |
| ② | 停止甲中反应,打开k、b,关闭a,持续通入N2一段时间 | 该操作的目的排净乙装置及导气管中的NO2 |
| ③ | 更换新的丙、丁装置,再通一段时间N2后关闭k,使甲中反应继续,观察到的现象与步骤①中相同 | 乙瓶中发生的化学反应方程式为3NO2+H2O=2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2 L O2含有的分子数为0.5NA | |
| B. | 在常温常压下,1 mol氦气含有的原子数为2NA | |
| C. | 71 g Cl2所含原子数为2NA | |
| D. | 标准状况下,1 mol H2O和1 mol H2的体积都约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com