
| A. | 4g 氦气 | B. | 1.25mol O2 | ||
| C. | 22.4升 Cl2(标准状况) | D. | 6.02×1023个SO2分子 |
分析 根据1摩任何物质的质量都是以克为单位,数值上等于该种原子的相对原子质量,每1摩尔任何物质含有阿伏伽德罗常数(约6.02×10^23)个粒子,进行分析解答.
解答 解:A、4g 氦气,即为1mol氦气,含原子数为:1mol;
B、1.25mol O2,含原子数为:1.25mol×2=2.5mol;
C、22.4升 Cl2(标准状况)的物质的量为1mol,含原子数为:2mol;
D、6.02×1023个SO2分子的物质的量为1mol,含原子数为:1×3=3mol;
由上述分析可知:6.02×1023个SO2分子中含原子数最多;
故选D.
点评 本题难度不大,考查学生根据物质的量(摩尔)与粒子数目之间的关系进行分析解题的能力.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 镍(28Ni)在金属羰基化合物[金属元素和一氧化碳(CO)中性分子形成的一类配合物]、金属储氢材料[能可逆的多次吸收、储存和释放氢气(H2)的合金]等领域用途广泛.
镍(28Ni)在金属羰基化合物[金属元素和一氧化碳(CO)中性分子形成的一类配合物]、金属储氢材料[能可逆的多次吸收、储存和释放氢气(H2)的合金]等领域用途广泛. ═
═ +2H+
+2H+查看答案和解析>>
科目:高中化学 来源: 题型:选择题
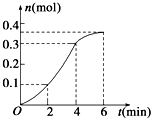
| A. | 反应开始2 min内平均反应速率最大 | |
| B. | 反应速率先增大后减小 | |
| C. | 反应2 min到第4 min内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2 min到第4 min内生成CO2的平均反应速率为前2 min的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于8.0 g | B. | 等于8.00 g | C. | 大于8.0 g | D. | 等于0.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术.反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术.反应①为主反应,反应②和③为副反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向HC1、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )
向HC1、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )| A. | M点对应的溶液中:K+、Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| B. | N点对应的溶液中:K+、NH${\;}_{3}^{+}$、HCO${\;}_{3}^{-}$、Cl- | |
| C. | S点对应的溶液中:Na+、Ag+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | |
| D. | R点对应的溶液中:Na+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com