
已知合成氨的反应为N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4 kJ•mol﹣1.
Ⅰ.在体积为5L的恒温、恒容密闭容器甲中,起始时投入2mol N2、3mol H2,经过10s达到平衡,测得平衡时NH3的物质的量为0.8mol.
Ⅱ.在容器乙中,起始时投入3mol N2、b mol H2,维持恒温、恒压达到平衡,测得平衡时NH3的物质的量为1.2mol.此时与容器甲中平衡状态温度相同,相同组分的体积分数都相同.
(1)容器甲10s内用H2表示的平均反应速率v(H2)= 0.024mol•L﹣1•s﹣1 ,达平衡时N2的转化率= 20% .
(2)甲容器中反应的逆反应速率随时间变化的关系如图.t2时改变了某一种条件,改变的条件可能是 升高了温度 、 增大了氨的浓度 (填写两项).
(3)下列哪些情况表明容器乙已达平衡状态 ACD (填字母).
A.容器乙中的气体密度不再变化
B.氨气的生成速率等于氮气的消耗速率的2倍
C.断裂1mol N≡N键同时断裂6mol N﹣H键
D.容器乙中气体的平均相对分子质量不随时间而变化.

| 化学平衡的影响因素;化学平衡状态的判断;化学平衡的计算.. | |
| 专题: | 化学平衡专题. |
| 分析: | (1)根据三段式结合题中数据进行计算; (2)根据图示中t2时的逆反应速率变化及影响化学反应速率的因素判断改变的条件; (3)根据达到平衡状态时,正逆反应速率相等,各组分的浓度不变进行判断. |
| 解答: | 解:(1)N2(g)+3H2(g)⇌2NH3(g) 起始量(mol) 2 3 0 转化量(mol)0.4 1.2 0.8 平衡量(mol)1.6 1.8 0.8 v(H2)= 平衡时,氮气的转化率= 故答案为:0.024mol•L﹣1•s﹣1;20%; (2)t2时,逆反应速率突然增大,原因可能是使用了催化剂、升高了温度、增大了压强、增大了氨的浓度,而后逆反应速率减小,平衡逆向移动,则只能是t2时增大了氨的浓度或升高了温度, 故答案为:升高了温度;增大了氨的浓度; (3)判断达到平衡的标准是“变化量不变”, A、恒温、恒压达到平衡下,容器乙中的气体密度不再变化,说明容器体积不再变化,可以说明反应达到平衡状态,故A正确; B、氨气的生成速率与氮气的消耗速率都是正反应速率,不能说明反应达到平衡状态,故B错误; C、断裂1molN≡N键同时断裂6molN﹣H键,即消耗1mol N2的同时消耗2mol NH3,说明正逆反应速率相等,说明反应达到平衡状态,故C正确; D、容器乙中气体的平均相对分子质量不随时间而变化,说明体系中各物质的体积分数不变,反应达到平衡状态,故D正确; 故选:ACD; |
| 点评: | 本题考查了化学平衡状态的判断、化学反应速率的计算等知识,题目难度中等,要求学生掌握化学平衡状态的判断方法、化学反应速率的计算方法. |


 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
对一份白色固体,经过初步分析得知,其含有Na2CO3、Na2SO4、NaCl、CuSO4等物质中的一种或几种。甲乙两位同学为了进一步确定这份白色固体的组成成份而进行了如下实验,但实验中的有些问题还需你来作答。
(1)甲取少量白色固体在试管内用水溶解,结果得无色澄清的液体。因此,甲说肯定有一种物质不存在。这种物质的化学式是:
(2)甲又先后向那试管内加入了稍过量的BaCl2溶液和稀硝酸,结果是先产生了白色沉淀,后又有一部分沉淀消失并从溶液里冒出无色气泡。因此甲又说肯定有两种物质存在。这两种物质是: 、 。
(3)乙将甲所得混合物进行了过滤,取滤液约2ml盛于另一支洁净的试管里,然后又向该试管内加入了稍过量的AgNO3溶液和稀硝酸,结果也产生了白色沉淀。因此乙说那份白色固体中也肯定有NaCl。你说乙的结论(填“对”或“不对”) ,理由是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,固定容积的密闭容器中反应:
2NO2(g) O2(g)+2NO(g);ΔH>0(正反应吸热), 达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
O2(g)+2NO(g);ΔH>0(正反应吸热), 达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
A.当X表示温度时,Y表示NO2的物质的量
B.当X表示压强时,Y表示NO2的转化率
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示O2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
用于净化汽车尾气的反应:2NO(g)+2CO(g)⇌2CO2(g)+N2(g),已知该反应570K时平衡常数为1×1059,但反应速率极慢.下列说法正确的是( )
|
| A. | 装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
|
| B. | 提高尾气净化效率的常用方法是升高温度 |
|
| C. | 增大压强,上述平衡右移,故可通过增压的方法提高尾气净化效率 |
|
| D. | 提高尾气净化效率的最佳途径是使用高效催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应N2(g)+3H2(g)⇌2NH3(g)△H<0,下列研究结果和示意图相符的是( )
| A | B | C | D | |
| 研究 结果 | 压强对反应的影响 | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物含有C、H、O三种元素,其球棍模型如图所示。该有机物可能发生的反应有①水解反应 ②加聚反应 ③取代反应 ④消去反应 ⑤银镜反应

A.①②③④⑤
B.①③④⑤
C.①③④
D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:
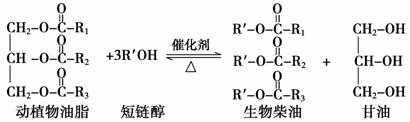
下列叙述错误的是
A.生物柴油由可再生资源制得 B.生物柴油是不同酯组成的混合物
C.“地沟油”可用于制备生物柴油 D.动植物油脂与醇的反应是皂化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列两种气体的分子数一定相等的是 ( )
A.质量相等、密度不等的N2和C2H4 B.等体积等密度的CO和NO
C.等体积的O2和N2 D.质量相等的N2和CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com