
| A. | NA个OH-含有电子10mol | |
| B. | 某元素R一个原子的质量是ag,则其的相对原子质量可表示为a NA | |
| C. | 4L0.5mol/L的NaOH溶液中含有阴离子的数目为2NA | |
| D. | 配制一定物质的量浓度的NaOH溶液时,定容时俯视操作所得溶液浓度偏低 |
分析 A.1个氢氧根离子含有10个电子;
B.摩尔质量以g/mol时,数值上与相对原子质量相同;
C.依据n=CV计算氢氧化钠的物质的量,结合1mol氢氧化钠含有1mol氢氧根离子解答;
D.俯视操作所得溶液体积偏小.
解答 解:A.NA个OH-的物质的量为1mol,含有电子10mol,故A正确;
B.某元素R一个原子的质量是ag,则其摩尔质量为a NAg/mol,相对原子质量可表示为a NA,故B正确;
C.4L0.5mol/L的NaOH溶液,含氢氧化钠物质的量为4L×0.5mol/L=2mol,含有阴离子的数目为2NA,故C正确;
D.俯视操作所得溶液体积偏小,依据C=$\frac{n}{V}$可知,溶液浓度偏高,故D错误;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,熟悉以物质的量为中心的相关公式,明确摩尔质量的概念是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
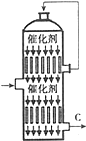 硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.
硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.| 压强 (Pa) 温度 (℃) | 1.013×105 | 5.065×105 | 10.13×105 | 15.195×105 |
| 400 | 99.61% | 99.72% | 99.84% | 99.88×105 |
| 500 | 96.75% | 97.67% | 98.52% | 98.94% |
| 600 | 85.20% | 88.97% | 92.76% | 94.68% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 加入催化剂,该化学反应的活化能和反应热都改变 | |
| B. | b曲线是加入催化剂时的能量变化曲线 | |
| C. | 该反应的热化学方程式为N2(g)+3H2(g)?2NH3(g);△H=-92kJ•mol-1 | |
| D. | 在温度、体积一定的条件下,通入lmol N2和3molH2 反应后放出的热量为Q1kJ,则Q1<92 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的盐酸中:c(H+)=4.0mol•L-1 | |
| B. | NH4Cl溶液中:c(Cl-)=c(NH4+) | |
| C. | NaCl溶液中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| D. | Na2CO3溶液中:c(HCO3-)+c(H2CO3)+c(CO32-)=2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精灯内的酒精用量一般不超过其容积的$\frac{2}{3}$,也不少于其容积的$\frac{1}{4}$ | |
| B. | 用氢气还原氧化铜时,应先通入氢气一会儿,然后再点燃酒精灯加热 | |
| C. | 实验室用高锰酸钾制取氧气结束时,应先将导管从水中取出,然后再停止加热 | |
| D. | 在分液操作中,应将上层液体从分液漏斗的上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g甲醇中含有C-H键的数目为4NA | |
| B. | 60g熔融的NaHSO4中含有的离子数目为1.5NA | |
| C. | Na2O2与足量H2O反应产生0.2mol O2,转移电子的数目为0.4NA | |
| D. | 惰性电极电解食盐水,当线路中通过电子数为NA时,阳极产生气体11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇能使酸性KMn04溶液和酸性K2Cr207溶液褪色,均被氧化成乙酸 | |
| B. | 向酸性高锰酸钾中加入草酸溶液,随着反应的进行,反应速率逐渐减小 | |
| C. | 向某溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该溶液中存在S042-或S032- | |
| D. | 实验室提纯混有少量氯化钠的硝酸钾,通常采用重结晶的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com