
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g) ②2HI(g)
NH3(g)+HI(g) ②2HI(g)![]() H2(g)+I2(g) 达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,,则此温度下反应①的平衡常数为
H2(g)+I2(g) 达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,,则此温度下反应①的平衡常数为
A. 9 B. 16 C. 20 D. 25
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学在能源开发与利用中起着十分重要的作用。
(1)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体。2017年我国在南海北部进行的可燃冰采取试验获得成功,标志着我国成为第一个实现在海域可燃冰试开采中获得连续稳定燃气的国家。已知:25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态水时放热55.6kJ。甲烷燃烧的热化学方程式为_____________。相同条件下,356g可燃冰(分子式为CH4·9H2O,Mr=178)释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为_____kJ。
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,具有清洁、高效的优良性能。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:(i)CO(g)+2H2(g) ![]() CH3OH(g)△H1=-90.1kJ/mol
CH3OH(g)△H1=-90.1kJ/mol
(ii)CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H2=-49.0kJ/mol
CH3OH(g)+H2O(g)△H2=-49.0kJ/mol
水煤气变换反应:(iii)CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H3=-41.1kJ/mol
CO2(g)+H2(g) △H3=-41.1kJ/mol
二甲醚合成反应:(iv)2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) △H4=-24.5kJ/mol
CH3OCH3(g)+H2O(g) △H4=-24.5kJ/mol
①分析二甲醚合成反应(iv)对于CO转化率的影响____________________。
②由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为:______________。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响__________________________。
(3)二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应为____,一个二甲醚分子经过电化学氧化,可以产生______个电子的电量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol-1,PCl3中P—Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是( )
A. P—P键的键能大于P—Cl键的键能
B. 可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C. Cl—Cl键的键能为![]() kJ·mol-1
kJ·mol-1
D. P—P键的键能为![]() kJ·mol-1
kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NaHCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。
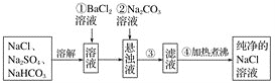
如果此方案正确,那么:
(1)操作①为什么不用硝酸钡溶液,其理由是___________________________________。
(2)进行操作①后,如何判断SO![]() 已除尽,方法是___________________________。
已除尽,方法是___________________________。
(3)操作②的目的是________,为什么不先过滤后加碳酸钠溶液?理由是________________________________________________________________________。
(4)操作③用到的玻璃仪器除烧杯、玻璃棒外,还需要____________________。
(5)操作④的目的是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧气性质的微型实验装置如图所示,①是浓盐酸,⑥是高锰酸钾,②至⑤是滤纸条,依次滴有石蕊试液、淀粉KI试液、KBr溶液、含KSCN的FeCl2几种溶液,实验时滴几滴浓盐酸,下列说法不正确的是
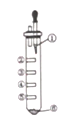
A. 产生氯气的离子方程式为:16H++10C1-+2MnO4-=2Mn2++5Cl2↑+8H2O
B. ⑤处变红色,发生反应为:2Fe2++Cl2=2Fe3++2C1-,Fe3++3SCN-=Fe(SCN)3
C. ②处先变红后褪色,能说明氯气溶于水后,溶液有酸性和强氧化性
D. ③处变蓝,④处变橙色能说明氧化性:Cl2>Br2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中CO2含量的增加会加剧温室效应,秉承“低碳环保,绿色出行”的生活理念,CO2的综合利用也成为热门研究领域。
I.CO2可用于生产乙烯。
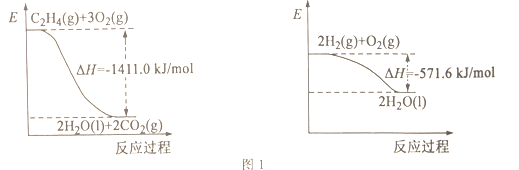
(1)依据图1写出CO2和H2生成C2H4和H2O(l)的热化学方程式________。
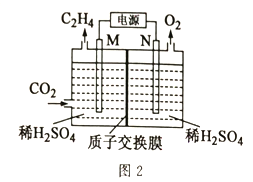
(2)以稀硫酸作电解质溶液,利用电解法将CO2转化为乙烯的装置如图2所示。M电极的电极反应式为_____,工作一段时间后,阳极室中溶液的pH_____(填“增大”“不变”或“减小”)。
Ⅱ.CO2与H2在一定条件下可生产二甲醚:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)Δ H<0
CH3OCH3(g)+3H2O(g)Δ H<0
(3)在2.0L恒容密闭容器中,加入2.0molCO2和6.0molH2,恒温条件下经过5min达到平衡状态,此时的压强是起始压强的2/3
①0~5min内反应的平均速率v(H2)=____,此温度下的平衡常数K=______.
②平衡常数K(800K)______K(900K)(填“>”“=”或“<”)
(4)分别以Cat.1和Cat.2作催化剂发生该反应,反应进行相同的时间后,测得CO2的转化率a(CO2)随反应温度T的变化情况如图3所示(忽略温度对催化剂活性的影响)。
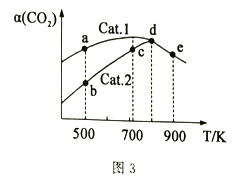
①该反应的活化能Ea(Cat.1)________Ea(Cat.2)(填“>”或“<”)。
②a、b、c、d、e五个状态中一定是平衡状态的是_______(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的量和摩尔质量的叙述,正确的是 ( )
A. 水的摩尔质量是18 g
B. 0.012 kg 12C中约含有6.02![]() 1023个碳原子
1023个碳原子
C. 1 mol水中含有2 mol氢和1 mol氧
D. 1 mol任何物质都含有6.02![]() 1023个分子
1023个分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3)以达到消除污染的目的。其工作原理的示意图如下:

下列说法不正确的是
A. Ir的表面发生反应:H2 + N2O == N2 + H2O
B. 导电基体上的负极反应:H2-2e == 2H+
C. 若导电基体上只有单原子铜,也能消除含氮污染物
D. 若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com