
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.分析 由化合价可知Y化合价有+6、-2价,应为ⅥA族元素,为S元素,M化合价只有-2价,为O元素,Z化合价为+5、-3,为ⅤA族元素,因原子半径大于O小于S,应为N元素,X化合价为+1价,为ⅠA族元素,原子半径大于S,为Na元素,R为+3价,属于ⅢA族元素,原子半径小于Na,大于S,为Al元素,结合对应单质、化合物的性质解答该题.
(1)R为+3价,属于ⅢA族元素,主族元素周期数=电子层数,主族族序数=最外层电子数,据此判断碳元素在周期表中位置;
(2)X与Y按原子个数比1:1构成的物质为Na2S2,过硫化钠是离子化合物,由钠离子与过硫根离子构成,过硫根离子中含有共价键;
(3)电子层数越多,半径越大,电子层数相同时,核电荷数越大半径越小;
(4)SO2气体通入FeCl3溶液中反应生成硫酸亚铁和盐酸;
(5)用Cu单质作阳极,石墨作阴极,Cu为活性电极,发生氧化反应,失去电子生成铜离子与碱反应生成氢氧化铜;
①若B为白色胶状不溶物,为Al(OH)3,A为可溶性的铝盐,如AlCl3等,X为强碱,C为偏铝酸盐;
②向B溶液中滴加铁氰化钾溶液有蓝色沉淀生成,则B为亚铁盐,结合铁三角进行分析.
解答 解:(1)由化合价可知Y化合价有+6、-2价,应为ⅥA族元素,为S元素,M化合价只有-2价,为O元素,Z化合价为+5、-3,为ⅤA族元素,因原子半径大于O小于S,应为N元素,X化合价为+1价,为ⅠA族元素,原子半径大于S,为Na元素,R为+3价,属于ⅢA族元素,原子半径小于Na,大于S,为Al元素,M为O元素,O的原子序数为8,其核外电子排布为1s22s22p4,则O元素位于周期表中第二周期第VIA族,
故答案为:Al;第二周期第VIA族;
(2)X与Y按原子个数比1:1构成的物质为Na2S2,过硫化钠是离子化合物,由钠离子与过硫根离子构成,电子式 ,硫原子之间通过共用电子对形成共价键,所含化学键类型为离子键、共价键,
,硫原子之间通过共用电子对形成共价键,所含化学键类型为离子键、共价键,
故答案为: ;离子键、共价键;
;离子键、共价键;
(3)X+,Y2?,M2?离子分别为Na+、S2?、O2?,电子层数越多,半径越大,S2?电子层数最多,电子层数相同时,核电荷数越大半径越小,则离子半径大小顺序为S2?>O2?>Na+,
故答案为:S2?>O2?>Na+;
(4)反应生成硫酸亚铁和盐酸,则将SO2气体通入FeCl3溶液中的离子反应为2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+,
故答案为:2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+;
(5)Cu为活性电极,发生氧化反应,电极反应式为:Cu+2OH?-2e?=Cu(OH)2,
故答案为:Cu+2OH--2e-=Cu(OH)2;
①若B为白色胶状不溶物,则A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C,为Al3+$\stackrel{O{H}^{-}}{→}$Al(OH)3$\stackrel{O{H}^{-}}{→}$AlO2?,A与C反应的离子方程式为Al3++3AlO2?+6H2O=4Al(OH)3↓,
故答案为:Al3++3AlO2?+6H2O=4Al(OH)3↓;
②向B溶液中滴加K3[Fe(CN)6](铁氰化钾)溶液,产生特征蓝色沉淀,说明含有二价铁离子,X为强氧化性酸,A与过量铁反应,则A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C,为过量的铁Fe$\stackrel{弱氧化性酸(如稀硝酸)}{→}$Fe2+$\stackrel{强氧化性酸(如浓硝酸)}{→}$Fe3+,则A与C反应的离子方程式为:Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+.
点评 本题考查元素位置结构和性质的关系及应用、铝、铁及其化合物之间的转化,电化学知识等,题目难度中等,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键,注意元素周期律的递变规律的应用,注意氢氧化铝的两性.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲池通入O2的电极反应为O2+4e-+4H+=2H2O | |
| B. | 乙池 Ag电极增重6.4g,溶液中将转移0.2mol电子 | |
| C. | 反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 | |
| D. | 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2+Br2→CH3CHBr2 | |
| B. | CH3CH═CH2+Br2→CH3CHBrCH2Br | |
| C. | CH3CH═CH2+Br2→CH3CH2CHBr2 | |
| D. | CH2═CH-CH═CH2+Br2(足量)→CH2═CH-CHBr-CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用金属活动性顺序可解释反应:Na(l)+KCl(l)═NaCl(l)+K(g) | |
| B. | 水的电离是吸热过程,升高温度,水的离子积增大、pH减小 | |
| C. | 对于平衡2HI(g)?I2(g)+H2(g),压缩容器体积,平衡不移动,气体的颜色不变 | |
| D. | 由反应SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,可得出C的非金属性强于Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
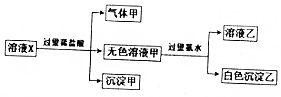 水溶液中只可能有K+、Mg2+、AlO2-、Al3+、SiO32-、CO32-、SO42-中的若干种离子,某同学对溶液进行了如下实验:下列判断错误的是( )
水溶液中只可能有K+、Mg2+、AlO2-、Al3+、SiO32-、CO32-、SO42-中的若干种离子,某同学对溶液进行了如下实验:下列判断错误的是( )| A. | 溶液X可能含有Mg2+或Al3+ | |
| B. | 沉淀甲只可能是硅酸沉淀 | |
| C. | 有气体甲生成,表明溶液X中一定含有CO32- | |
| D. | 不能确定SO42-是否存在于溶液X中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
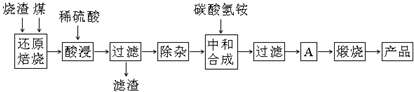
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为sp3
.C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为sp3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com