
【题目】近年来,我国储氢碳管研究获得重大进展,电弧法合成碳纳米管,常伴有大量物质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
3C + 2K2Cr2O7 + 8H2SO4(稀)= 3CO2↑ + 2K2SO4 + 2Cr2(SO4)3 + 8 H2O
请回答下列问题。
(1)H2O的摩尔质量为___________,0.18g H2O的物质的量为_______________mol
(2)配制0.1mol/L H2SO4溶液500mL,则需要H2SO4的质量为_____________g
(3)在上述的反应中,若生成22g CO2
ⅰ.标准状况下,CO2的体积为_________L
ⅱ.转移电子的数目为________________
(4)标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,则该混合气体的平均相对分子质量是_____________
【答案】 18 g/mol 0.01 4.9 11.2 2NA或1.204×1024 40
【解析】试题分析:本题是以物质的量为中心的基础计算题,重点考查摩尔质量、平均相对分子质量基本计算,考查物质的量与质量、气体体积、溶质物质的量浓度、微粒数目的换算,考查氧化还原反应中电子转移的计算。
解析:(1)以g/mol为单位时,摩尔质量在数值上等于该物质的相对分子质量。H2O的相对分子质量为18,所以其摩尔质量为18g/mol。因此,0.18g H2O物质的量![]() 。正确答案: 18 g/mol、0.01。(2)所需溶质H2SO4的物质的量为0.1mol/L×0.5L=0.05mol,H2SO4质量为0.05mol×98g/mol=4.9g。正确答案:4.9g。 (3)i.CO2的物质的量为22g÷44g/mol=0.5mol,标准状况下体积为0.5mol×22.4L/mol=11.2L 。 ii.原反应中C元素从0价升高到+4价,且无其他升高价态,所以反应生成0.5mol CO2时转移的电子数为4×0.5mol=2mol,N=2mol×6.02×1023mol-1=1.204×1024。正确答案:11.2、1.204×1024。(4)以g/mol为单位时,混合气体的摩尔质量在数值上等于其平均相对分子质量,
。正确答案: 18 g/mol、0.01。(2)所需溶质H2SO4的物质的量为0.1mol/L×0.5L=0.05mol,H2SO4质量为0.05mol×98g/mol=4.9g。正确答案:4.9g。 (3)i.CO2的物质的量为22g÷44g/mol=0.5mol,标准状况下体积为0.5mol×22.4L/mol=11.2L 。 ii.原反应中C元素从0价升高到+4价,且无其他升高价态,所以反应生成0.5mol CO2时转移的电子数为4×0.5mol=2mol,N=2mol×6.02×1023mol-1=1.204×1024。正确答案:11.2、1.204×1024。(4)以g/mol为单位时,混合气体的摩尔质量在数值上等于其平均相对分子质量, ![]() ,
, ![]() ,平均相对分子质量为40。正确答案:40。
,平均相对分子质量为40。正确答案:40。


科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.任何可逆反应都有一定的限度
B.化学反应达到平衡状态时,正、逆反应速率相等
C.化学反应达到平衡状态与时间的长短无关
D.化学平衡状态是不可改变的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L的密闭容器中加入1molX、3molZ和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是
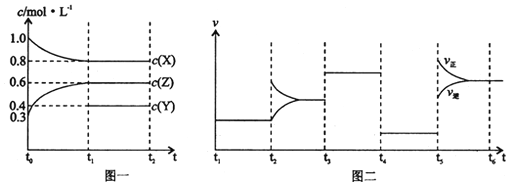
A. Y的起始物质的量为0.5mol
B. 该反应的化学方程式为:2X(g)+Y(g)![]() 3Z(g)ΔH<0
3Z(g)ΔH<0
C. 若t0=0,t1=10s,则t0-t1阶段的平均反应速率为v(z)=0.03mol/(L﹒s)
D. 反应物X的转化率t6点比t3点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 可用铝罐贮运浓硝酸 B. 弱酸一定不能制备强酸
C. 复分解反应可能也是氧化还原反应 D. 炼铁高炉的高度越髙,尾气中CO的含量越少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示转化关系(X代表卤素),说法不正确的是

A.2H(g) +2X(g) == 2HX(g) ΔH3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3
C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.向盐酸中滴加氨水:H++OH-=H2O
B.氯化钙与碳酸氢钾溶液混合:Ca2++CO32-=CaCO3↓
C.氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O
D.Ca(HCO3)2溶液中加入过量KOH溶液:Ca2++HCO3﹣+OH﹣═CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
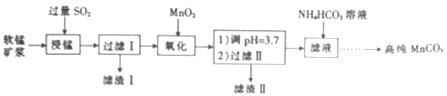
(1)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为____和_____(填离子符号)。
(2)写出氧化过程中MnO2与SO2反应的化学方程式:____________。
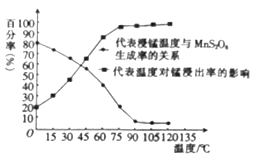
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是___________。
(4)向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度控制在30-35℃,温度不宜太高的原因是___。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_______。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是
A. 汽油、柴油和润滑油和植物油的主要成分都是碳氢化合物
B. 在紫外线、饱和(NH4)2SO4溶液、CuSO4溶液、福尔马林等作用下,蛋白质均会发生变性
C. 煤的干馏、汽化、液化都是化学变化,是高效、清洁地利用煤的重要途径
D. 所有糖类、油脂、蛋白质在一定条件下都能发生水解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com