
 2SO3(g),利用三段式法计算法,求出反应混合物各组分的物质的量的变化量、平衡时各组分的物质的量.
2SO3(g),利用三段式法计算法,求出反应混合物各组分的物质的量的变化量、平衡时各组分的物质的量.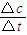 计算v(SO2).
计算v(SO2).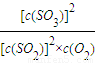 .
. 2SO3(g),
2SO3(g),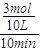 =0.03mol/(L?min).
=0.03mol/(L?min).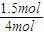 ×100%=37.5%.
×100%=37.5%.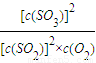 =
= =9mol-1?L
=9mol-1?L

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com