
| A. | ①②③④ | B. | 仅①②③ | C. | 仅①③④ | D. | 仅①②④ |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
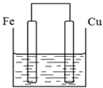 将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置(以下均假设反应过程中溶液体积不变).
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置(以下均假设反应过程中溶液体积不变).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和M的原子序数之差为6 | |
| B. | A和M原子的最外层电子数之差为7 | |
| C. | A和M原子的最外层电子数之和可能为9 | |
| D. | A和M原子的电子总数之和可能为11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟离子的结构示意图: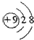 | |
| B. | 氮分子的电子式: | |
| C. | 水分子的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-H+ | |
| D. | C-14原子:${\;}_{6}^{14}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸与氢氧化钾溶液反应 H++OH-→H2O | |
| B. | 铝与稀盐酸反应 Al+2H+→Al3++H2↑ | |
| C. | 氯化铁溶液与氢氧化钠溶液反应 FeCl3+3OH-→Fe(OH)3↓+3C1- | |
| D. | 二氧化碳与石灰水反应 CO2+2OH-→CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(X)=0.5mol•s-1 | B. | v(X)=0.025mol•L-1•s-1 | ||
| C. | v(y)=0.05mol•L-1•s-1 | D. | v(y)=0.075mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲烧杯中锌片逐渐溶解,乙烧杯中锌片不溶解 | |
| B. | 两烧杯中铜片表面均无气泡产生 | |
| C. | 两烧杯中溶液的酸性均减弱 | |
| D. | 甲烧杯中铜片上的电极反应为:Cu2++2e-=Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com