
| A. | 原子数相同 | B. | 中子数相同 | C. | 质子数相同 | D. | 气体质量不相同 |
分析 依据阿伏伽德罗常数定律可知:同温同压下,等体积的两容器所盛放的气体的分子数相等,结合14N16O和13C16O所含原子数、中子数、质子数判断.
解答 解:1个14N16O含有2个原子,15个中子,15个质子,1个13C16O含有2个原子,15个中子,14个质子,
依据阿伏伽德罗常数定律可知:同温同压下,等体积的两容器所盛放的气体的分子数相等,设14N16O和13C16O物质的量都是1mol,则含有原子数都是2mol,中子数都是15mol,质子数分别为15mol和14mol,依据m=nM可知气体质量分别为30g,29g,
故选:C.
点评 本题考查了有关物质的量的计算,熟悉阿伏伽德罗常数定律及物质所含原子、中子、质子数目是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 聚2一乙烯吡啶的复合物与有机物性质相似,因此聚2一乙烯吡啶的复合物不会导电 | |
| B. | 正极的反应为P2VP•nI2+2Li++2e-═P2VP•(n-1)I2+2LiI | |
| C. | 电池工作时,碘离子移向P2VP一极 | |
| D. | 该电池所产生的电压低,使用寿命比较短 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HCO3-、SO42- | B. | K+、Cu2+、Cl-、NO3- | ||
| C. | NH4+、Al3+、Br-、SO42- | D. | Na+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砹为有色固体 | |
| B. | HAt 很稳定 | |
| C. | AgAt易溶于水 | |
| D. | 砹单质的熔沸点比碘单质的熔沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Q>W | |
| B. | Q和W可形成原子个数比为1:1和2:1的化合物 | |
| C. | X 与W能形成两种常见的化合物 | |
| D. | Y单质既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2S03溶液中加入硝酸酸化的BaCl2,有白色沉淀出现,说明Na2S03溶液已经变质 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 等体积、pH都为3的酸HCl和CH3COOH分别与足量的锌反应,放出的氢气一样多 | |
| D. | 硫酸铁可用于净水,因为三价铁离子可水解生成Fe(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
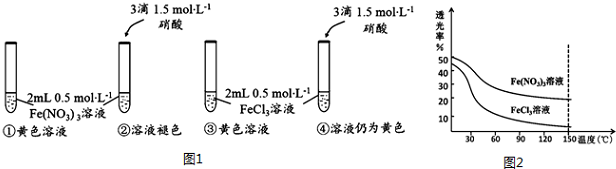
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com