
����Ŀ����.4.1gH3PO3����2gNaOH��ȫ��Ӧ�������Σ���H3PO3Ϊ__________Ԫ�ᡣ�����εĵ��뷽��ʽΪ_________________��
��С�մ�θ��ƽ����ϲ���dz��õ��к�θ���ҩ�
(1)С�մ�ƬÿƬ��0.504gNaHCO3��2ƬС�մ�Ƭ���к�θ���е�H+��_____mol��
(2)θ��ƽÿƬ��0.234gAl(OH)3���к�θ��ʱ��6ƬС�մ�Ƭ�൱��θ��ƽ__________��
(3)��ϲ�Ļ�ѧ�ɷ�������þ�ļ�ʽ̼���Ρ�ȡ�ü�ʽ�η�ĩ3.01g����μ���2.0mol/L����ʹ���ܽ�(�����ɷֲ������ᷴӦ)������������42.5mLʱ����ʼ����CO2������������45.0mLʱ���÷�Ӧ��ȫ����ü�ʽ����Ʒ����������̼��������ʵ���֮��Ϊ____________��
���𰸡� һ NaH2PO3=Na++H2PO3- 0.012 4 16��1
������������4.1gH3PO3�����ʵ�����4.1g��82g/mol��0.05mol��2gNaOH�����ʵ�����2g��40g/mol��0.05mol�����߰������ʵ���֮��1��1��ȫ��Ӧ�������Σ���H3PO3ΪһԪ�ᡣ�����εĵ��뷽��ʽΪNaH2PO3=Na++H2PO3����
������1��С�մ�ƬÿƬ��0.504gNaHCO3��2ƬС�մ�Ƭ��̼�����Ƶ����ʵ�����1.008g��84g/mol��0.012mol��������к�θ���е�H+��0.012mol����2��0.234gAl(OH)3�����ʵ�����0.234g��78g/mol��0.003mol������к�θ��ʱ��6ƬС�մ�Ƭ�൱��θ��ƽ![]() Ƭ����3���йط�Ӧ�ķ���ʽ������NaOH��HCl��NaCl��H2O��HCl��Na2CO3��NaHCO3��NaCl��NaHCO3��HCl��NaCl��H2O��CO2��������������42.5mLʱ����ʼ����CO2������������45.0mLʱ���÷�Ӧ��ȫ������̼�������Ӧ��������45mL��42.5mL��2.5mL����������ʵ�����0.005mol������̼����������ʵ�����0.005mol����̼��������ʵ���Ҳ��0.005mol������������̼�����Ӧ������������ʵ�����0.0425L��2mol/L��0.085mol��������������Ӧ��������0.085mol��0.005mol��0.08mol�����������������ʵ�����0.08mol����ü�ʽ����Ʒ����������̼��������ʵ���֮��Ϊ16��1��
Ƭ����3���йط�Ӧ�ķ���ʽ������NaOH��HCl��NaCl��H2O��HCl��Na2CO3��NaHCO3��NaCl��NaHCO3��HCl��NaCl��H2O��CO2��������������42.5mLʱ����ʼ����CO2������������45.0mLʱ���÷�Ӧ��ȫ������̼�������Ӧ��������45mL��42.5mL��2.5mL����������ʵ�����0.005mol������̼����������ʵ�����0.005mol����̼��������ʵ���Ҳ��0.005mol������������̼�����Ӧ������������ʵ�����0.0425L��2mol/L��0.085mol��������������Ӧ��������0.085mol��0.005mol��0.08mol�����������������ʵ�����0.08mol����ü�ʽ����Ʒ����������̼��������ʵ���֮��Ϊ16��1��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ���¶��µ��ܱ������д������·�Ӧ��CO��g��+H2O��g��CO2��g��+H2��g��֪CO��H2O����ʼŨ�Ⱦ�Ϊ2mol/L���ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K=1�����жϣ�
��1����COת����Ϊ25%ʱ���÷�Ӧ�����ǻ�ﵽƽ��״̬����δ�ﵽ���������ƶ���
��2����ƽ��״̬ʱ��CO��ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ӣ����ܴ�����������ɫ��Һ�е��� �� ��
A. Na+��H+��CO32-��NO3- B. Fe3+��Mg2+��Cu2+��Cl-
C. Na+��OH-��HCO3-��Cl- D. Ba2+��Cl-��NO3-��OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ��һ���ܴ���������ǣ� ��
A.ˮ�����c�� H+��=1xl0��13 mol/L����Һ�У�K+��Na+��SiO ![]() ��SO
��SO ![]()
B.1.0 mol/L��CH3COOH��Һ��K+��Fe3+��NO ![]() ��Cl��
��Cl��
C.��c��OH������c��H+��=1��1012����Һ��NH ![]() ��Ca2+��C1����K+
��Ca2+��C1����K+
D.�����Ի�ɫ����Һ��Na+��CO ![]() ��NO
��NO ![]() ��SO
��SO ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2��H2�ϳ�NH3�������仯��ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ�ǣ� �� 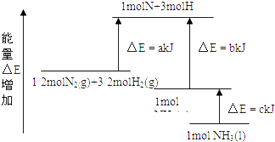
A.N2��g��+3H2��g��2NH3��g������H=2��b��a�� kJ/mol
B.N2��g��+3H2��g��2NH3��l������H=2��a��b��c�� kJ/mol
C.![]() N2��g��+
N2��g��+ ![]() H2��g��NH3��l������H=��b+c��a�� kJ/mol
H2��g��NH3��l������H=��b+c��a�� kJ/mol
D.![]() N2��g��+
N2��g��+ ![]() H2��g��NH3��g������H=��a+b�� kJ/mol
H2��g��NH3��g������H=��a+b�� kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ����ú�ˮ�����Ʊ���ˮ��ʳ�Ρ����������ʣ���������ͼ��ʾ��
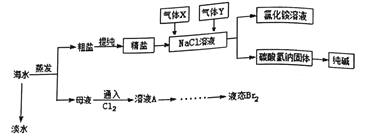
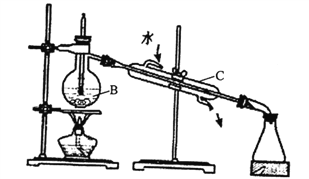
(1)ʵ�����п�����ͼװ�ôӺ�ˮ�л�õ�ˮ��B��C���������Ʒֱ���B____________��C_________��Bװ����������ӷ�ʯ��Ӧ_________����ͼװ������___________������
(2)��ĸҺ��ͨ���������û��������壬����ҺA ����ȡBr2����Ҫ����Ҫ������__________��
(3)�����к���Na2SO4��MgCl2��CaCl2�ȿ��������ʣ�Ϊ�Ƶô�����NaCl���壬�������£�
a���ܽ⣻b�����μ��������_________��Һ��NaOH ��Һ��c��_________��d����������� e��___________ (�벹ȫȱ�ٵ��Լ���ʵ�鲽��)��
(4)ʵ������Ҫʹ��480mL0.1mol/L�ĸþ�������Һ�������Ƹ���Һʱ��
����Ҫ��������ƽ�����Ȼ��Ƶ�����____________ g��
������ʵ�������ʹ���ƽ��ƫ�ߵ���_______��
A.���������� B.����ʱ���ӿ̶���
C.ûϴ���ձ��Ͳ����� D.����ƿ�в�����������ˮ
E.����ҡ�Ⱥ���Һ����ڿ̶��ߣ��ּ���������ˮ��Һ����̶�������
(5)���Ȼ�����Һ���Ⱥ�ͨ�������X��Y �Ļ�ѧʽ�ֱ�Ϊ_________��____________������Ϊ��ͨ����X��ԭ����_______________���÷�Ӧ�Ļ�ѧ����ʽΪ__________________��
(6)�����ַ����Ƶõ�Na2CO3����������NaCl�������Na2CO3��������NaCl��ʵ�����Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ѻӷ��Զ����㣨TaS2���ɲ�������װ���ᴿ����������TaS2��ĩװ��ʯӢ��һ�ˣ�����պ����������Ⲣ��ܣ����ڼ���¯�У���Ӧ���£�TaS2��s��+2I2��g��TaI4��g��+S2��g������˵����ȷ���ǣ� �� ![]()
A.�ڲ�ͬ�¶�����TaI4�������ֲ���
B.���ᴿ�����У�I2�������ϼ���
C.���ᴿ�����У�I2�������ǽ�TaS2�Ӹ�����ת�Ƶ�������
D.�÷�Ӧ��ƽ�ⳣ����TaI4��S2��Ũ�ȳ˻��ɷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����Fe��FeO��Fe2O3�Ļ�������2mol/L��HNO3��Һ25mL�У���Ӧ��ȫ������ʣ�࣬����224mL NO���壨��״����������Ӧ�����Һ�м���1mol/L��NaOH��Һ��Ҫʹ��Ԫ��ȫ����������������NaOH��Һ����������ǣ� ��
A.40mL
B.45mL
C.50mL
D.��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ú�ˮ��ɹ�Ρ��ķ����õ��Ĵ����У����Ȼ����⣬�������Ȼ�þ���Ȼ��ơ������Ƶ����ʡ����˴����ᴿ�IJ���ʵ�鷽�����£�
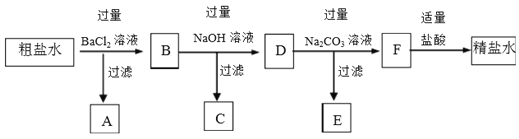
��1������ˮ�к��е���������_______����������__________��
��2������BaCl2��Һ��Ŀ���ǣ������ӷ���ʽ��ʾ��_________��
��3�����ɳ���C�����ӷ���ʽ��______��
��4��D������������_______��
��5��E����Ҫ�ɷֵĻ�ѧʽ��____��
��6�������������������������Ŀ����________��
��7��ijͬѧ��Ϊ�������K2CO3��Һ��������Na2CO3��Һͬ�����Դﵽʵ��Ŀ�ģ�����˵���Ƿ��������˵������______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com