
| A. | X为0.05 mol•L-1 | B. | Y为0.1 mol•L-1 | C. | Z为0.2 mol•L-1 | D. | W为0.1 mol•L-1 |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:若反应向正反应进行,假定完全反应,则:
X(g)+Y(g)?2Z(g)+W(s),
开始(mol/L):0.1 0.2 0 0
变化(mol/L):0.1 0.1 0.2 0.1
平衡(mol/L):0 0.1 0.2 0.1
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X)<0.1,0.1<c(Y)<0.2,0<c(Z)<0.2,W<0.1,故A正确、BCD错误;
故选:A.
点评 本题考查化学平衡的建立,关键是利用可逆反应的不完全性,运用极限假设法解答,难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由SiO2构成的晶体有:水晶、玛瑙、石英晶体 | |
| B. | 胶体的电泳现象的产生,是由于胶体带电,胶体在外加电场下可以定向流动 | |
| C. | 明矾可用于自来水的净化和杀菌消毒 | |
| D. | Fe3+与SCN-形成的配合物,常用于电影特技和魔术表演 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
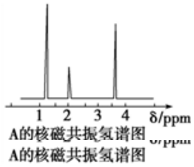
| A. | CH3CH2CH3 | B. | CH3CHO | C. | CH3CH2OH | D. | CH3CH2CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 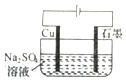 装置可实现:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2+H2↑ | |
| B. | 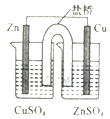 装置能构成锌铜原电池 | |
| C. | 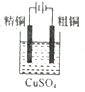 装置可用于粗铜的电解精炼 | |
| D. |  装置可用于浓硫酸干燥氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在淀粉溶液中加入稀硫酸加热一段时间后,再滴加银氨溶液检验淀粉的水解产物 | |
| B. | 测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中 | |
| C. | 用蒸馏水湿润pH试纸后测定硫酸钠溶液的pH | |
| D. | 用酸碱中和滴定法测定未知浓度的碱液时,在锥形瓶中加入2-3mL酚酞试液作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
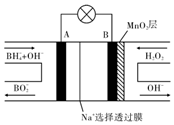 新型$\frac{NaB{H}_{4}}{{H}_{2}{O}_{2}}$燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )
新型$\frac{NaB{H}_{4}}{{H}_{2}{O}_{2}}$燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )| A. | 纳米MnO2层的作用是提高原电池的工作效率 | |
| B. | 放电过程中,Na+从B极区移向A极区 | |
| C. | 电池负极的电极反应为:BH4+8OH--8e一═BO2-+6H2O | |
| D. | 在电池反应中,每消耗1L 1mol/L H2O2溶液,理论上流过电路中的电子为2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com