
【题目】(1)6.8克NH3的物质的量为______mol,含质子的物质的量为______mol,该气体在标准状况下的体积为_______L.
(2)4.8gO3和0.2molCH4,质量之比是_______,在同温同压下的体积之比是______.相同质量的O2和SO2,所含分子的数目之比为______,所含O 原子的物质的量之比为______。
科目:高中化学 来源: 题型:
【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为__________。
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK________NaClO,两溶液中:[c(Na+)-c(ClO-)]________[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(3)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。
(4)取10 mLpH=2的CH3COOH溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中![]() 的比值将________(填“增大”“减小”或“无法确定”)。
的比值将________(填“增大”“减小”或“无法确定”)。
(5)向碳酸钠溶液中滴加少量氯水的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修5:有机化学基础】
A(C3H6)是基本有机化工原料。由A制备聚合物C和![]() 的合成路线(部分反应条件略去)如图所示。
的合成路线(部分反应条件略去)如图所示。

已知:![]() +‖
+‖![]()
![]() ;R—C≡N
;R—C≡N![]() R—COOH
R—COOH
回答下列问题:
(1)A的名称是______________,B含有的官能团的名称是________________(写名称)。
(2)C的结构简式为________________,D→E的反应类型为________。
(3)E→F的化学方程式为________________________________________。
(4)![]() 中最多有________个原子共平面。
中最多有________个原子共平面。
(5)B的同分异构体中,与B具有相同的官能团且能发生银镜反应的共有________种;其中核磁共振氢谱为3组峰,且峰面积之比为6∶1∶1的是_____________________(写结构简式)。
(6)结合题给信息,以乙烯、HBr为起始原料制备丙酸,设计合成路线(其他试剂任选)。
合成路线流程图示例:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3。
CH3COOCH2CH3。
_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示。下列说法中不正确的是 ( )
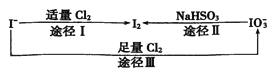
A. 用淀粉-KI试纸和食醋检验加碘盐时淀粉-KI试纸会变蓝
B. 足量Cl2能使湿润的、已变蓝的淀粉-KI试纸褪色的原因可能是5Cl2+I2+6H2O=2HIO3+10HCl
C. 由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D. 途径II中若生成1molI2,则反应中转移的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 煤的液化和气化是物理变化 B. 淀粉、油脂和蛋白质都是高分子化合物
C. 乙烯和乙醇均可使酸性KMnO4溶液褪色 D. 工业上获得苯主要通过石油的分馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质之间通过一步反应不能实现如图所示转化的是( )
选项 | a | b | C | m |
A | 氢氧化钠 | 碳酸钠 | 碳酸氢钠 | 二氧化碳 |
B | 硝酸 | 硝酸铁 | 硝酸亚铁 | 铁 |
C | 硫酸铝 | 氢氧化铝 | 偏铝酸钠 | 氢氧化钠 |
D | 氮气 | 一氧化氮 | 二氧化氮 | 氧气 |

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。
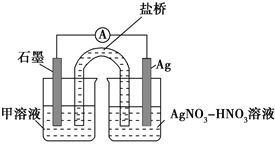
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为第ⅡA族元素,B为第ⅢA族元素,它们的原子序数分别为m和n,且A、B在同一周期。下列关系式必定错误的是( )
A. n=m+1
B. n=m+10
C. n=m+11
D. n=m+25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制480 mL 1 mol·L-1 NaOH溶液,下列叙述正确的是( )
A. 转移液体时,玻璃棒应紧靠容量瓶口
B. 用托盘天平称量19.2 g NaOH固体
C. 容量瓶上标有温度、浓度、容积和压强
D. 定容时若俯视刻度线观察液面,会使所配制的NaOH溶液的浓度偏高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com