
| A. | 10℃时pH=12的Na0H溶液与40℃时pH=12的Na0H溶液中:c(OH-)相等 | |
| B. | 25℃时pH=10的NaOH溶液与pH=10的氨水中:c(Na+)═c(NH4+) | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH) | |
| D. | 向10mLpH=12的Na0H溶液中滴加pH=2的HA溶液达中性:则混合液体积V总≥20mL |
分析 A.温度影响水的离子积,两溶液中氢离子浓度相同,而水的离子积不同,则两溶液中氢氧根离子浓度不同;
B.两溶液中氢离子、氢氧根离子浓度相等,结合电荷守恒判断;
C.根据混合液中的物料守恒和电荷守恒分析;
D.如果HA是强酸,二者浓度相等,要使混合溶液呈中性,则两种溶液体积相等;如果HA是弱酸,则HA浓度大于NaOH,要使混合溶液呈中性,则碱体积大于酸.
解答 解:A.10℃时pH=12的Na0H溶液与40℃时pH=12的Na0H溶液中的氢离子浓度相同,而水的离子积不变,c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$,则两溶液中氢离子浓度不相等,故A错误;
B.25℃时pH=10的NaOH溶液与pH=10的氨水中的氢离子、氢氧根离子浓度相等,根据电荷守恒可知:c(Na+)=c(OH-)-c(H+)=c(NH4+),故B正确;
C.物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+),由上述两个式子可得:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),故C正确;
D.如果HA是强酸,二者浓度相等,要使混合溶液呈中性,则两种溶液体积相等;如果HA是弱酸,则HA浓度大于NaOH,要使混合溶液呈中性,则碱体积大于酸,所以所得溶液体积(假设混合后的体积是两溶液体积之和)V(总)≤20mL,故D错误;
故选BC.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断等知识,题目难度中等,明确盐的水解原理、电荷守恒、物料守恒的含义为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:填空题
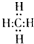 ,分子里各原子的空间分布呈正四面体结构.相对分子质量为212的烷烃的分子式为C15H32.分子式为C8Hm的烯烃,m值等于16;分子式为CnH8的苯的同系物,n值等于7.
,分子里各原子的空间分布呈正四面体结构.相对分子质量为212的烷烃的分子式为C15H32.分子式为C8Hm的烯烃,m值等于16;分子式为CnH8的苯的同系物,n值等于7.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1molHCl气体中的粒子数与0.5mol/L盐酸中溶质粒子数相等 | |
| C. | 22.4L的CO气体与1molN2所含的电子数相等 | |
| D. | 任何条件下,16gCH4与18gH2O所含有电子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
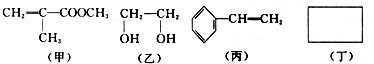
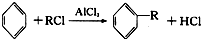 (-R为烃基)
(-R为烃基)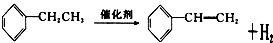
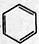 +CH3CH2Cl
+CH3CH2Cl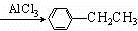 +HCl.
+HCl.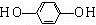 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
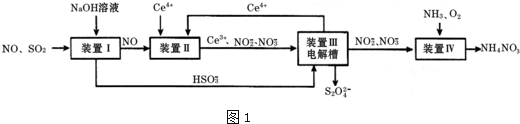
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用甲醛溶液浸泡海产品保鲜 | |
| B. | 无水乙醇常用作医用消毒剂 | |
| C. | 人的皮肤在强紫外线的照射下将会失去生理活性 | |
| D. | 做衣服的棉和麻均与淀粉互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用新制的Cu(OH)2可鉴别乙醛、乙酸、乙醇 | |
| B. | 除去乙烷中少量乙烯:光照条件下通入Cl2,气液分离 | |
| C. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 | |
| D. | 除去苯中混有的苯酚:向混合液中加入过量的NaOH溶液,充分反应后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径A2->C->B2+ | B. | 它们的原子半径C>B>A | ||
| C. | 它们的原子序数A>B>C | D. | 原子最外层上的电子数C>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
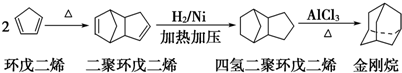
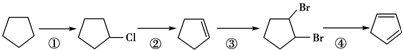
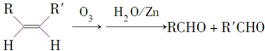 ,请写出下列反应产物的结构简式:
,请写出下列反应产物的结构简式: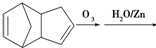
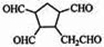 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com