
| A. | 0.1mol苯分子中含有双键数为0.3NA | |
| B. | 1L1mol•L-1碳酸钠溶液中阴离子的数目大于NA | |
| C. | 标准状况下,22.4L乙烷中共含有分子数为NA | |
| D. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,转移的电子的数目为0.92NA |
分析 A.苯分子中不含有碳碳双键;
B.碳酸根离子水解生成碳酸氢根离子和氢氧根离子;
C.依据n=$\frac{V}{Vm}$计算乙烷的物质的量,N=nNA;
D.浓硫酸随反应进行,浓度变稀后不和铜反应;
解答 解:A.苯分子中碳碳键是介于单键和双键之间独特的化学键,不含双键,故A错误;
B.碳酸钠在水中发生水解,当生成碳酸氢钠时,每有1mol碳酸氢钠生成同时生成1mol氢氧根,所以溶液中阴离子大于NA,故B正确;
C.标准状况下,22.4L乙烷物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,含有分子数为NA,故C正确;
D.浓硫酸随反应进行,浓度变稀后不和铜反应,50mL 18.4mol/L浓硫酸与足量铜微热反应,转移的电子的数目小于0.92NA,故D错误;
故选:BC.
点评 本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用、盐类的水解、浓硫酸与铜的反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L氯气溶于水转移电子数为NA | |
| B. | 1L 0.1mol/L的硫酸铁溶液中含有铁离子的数目为0.2NA | |
| C. | 向氨气合成塔中通入amolN2和3amolH2的混合气,充分反应后生成N-H数为6aNA | |
| D. | 电解硫酸铜溶液时,当阳极产生22.4L(标况)气体,体系中转移电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
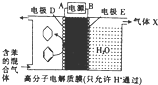 一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )
一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )| A. | A为电源的正极 | |
| B. | 气体X为H2 | |
| C. | 电极E为阴极 | |
| D. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由SO2制亚硫酸钠:SO2$\stackrel{Na_{2}CO_{3}溶液}{→}$NaHSO3溶液$→_{调节溶液的pH}^{NaOH溶液}$Na2SO3溶液 | |
| B. | 由NaCl制漂白粉精:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{澄清石灰水}{→}$漂粉精 | |
| C. | 由NH3制硝酸:NH3$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| D. | 由乙烯制乙酸:H2C=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{△}^{CuO_{2}}$CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
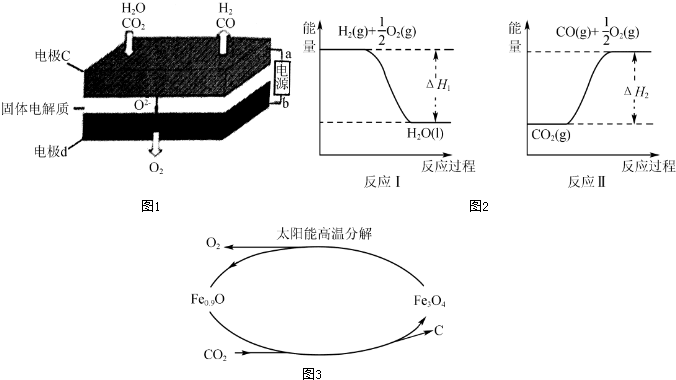
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存 | |
| B. | 和KI溶液反应的离子方程式:2Fe3++2I-=2Fe2++I2 | |
| C. | 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓ | |
| D. | 1L0.1mol/L该溶液和足量的Ca充分反应,生成11.2gFe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知A-+H2B(过量)=HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 在25℃时,将cmol/L的醋酸溶液与0.02mol/LNaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02) | |
| C. | 若将CO2 通入0.1 mol/LNaOH溶液中至溶液中性,则溶液中2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol/L | |
| D. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
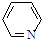 ),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.
),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.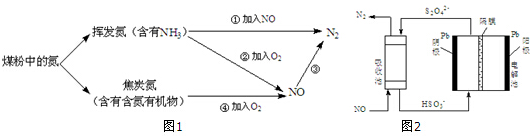
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用无色试剂瓶盛放浓硝酸 | B. | 用铁质容器盛放浓硫酸 | ||
| C. | 用玻璃试剂瓶盛放氢氟酸 | D. | 用带橡胶塞的试剂瓶盛放苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com