
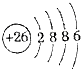
| A. | 28g CO、C2H4混合气体的分子总数NA,体积约为22.4L | |
| B. | 9.2g金属钠投入到足量的重水中所得气体中含有0.4NA中子 | |
| C. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 0.1mol/LFeCl3溶液中所含Fe3+的数目小于0.1NA |
分析 A、CO和乙烯所处的状态不明确;
B、求出钠的物质的量,然后根据钠和重水反应生成重氢来分析;
C、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L;
D、溶液体积不明确.
解答 解:A、CO和乙烯所处的状态不明确,故气体的体积无法确定,故A错误;
B、9.2g钠的物质的量n=$\frac{9.2g}{23g/mol}$=0.4mol,而0.4mol钠和重水反应生成0.2mol重氢,故含0.4mol中子即0.4NA个,故B正确;
C、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L,故1L溶液中氢氧根的物质的量为0.1mol,即0.1NA个,故C错误;
D、溶液体积不明确,故溶液中的铁离子的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
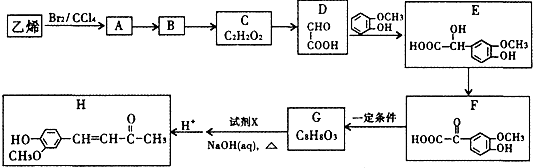

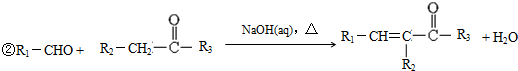
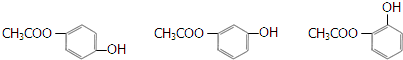 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用2Al+2NaOH+2H2O=2NaAlO2+3H2反应,设计一个原电池.
利用2Al+2NaOH+2H2O=2NaAlO2+3H2反应,设计一个原电池.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-戊烯和2-甲基-1-丙烯 | B. | 甲醛和甲酸甲酯 | ||
| C. | 1-丁醇和甲乙醚 | D. | 丁酸和乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
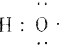 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同
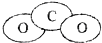

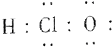
| A. | (1)(2)(4)(6) | B. | (2)(3)(5) | C. | (1)(4)(5) | D. | (1)(2)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
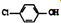 )的酸性废水,可利用微生物电池法除去,其原理如图2所示
)的酸性废水,可利用微生物电池法除去,其原理如图2所示 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-
-OH+Cl-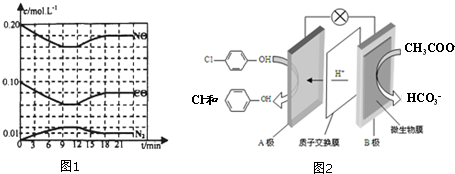
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将0.1mol•L-1 Na2CO3溶液滴入BaCl2溶液至不再有沉淀产生,再滴加0.1mol•L-1 Na2SO4溶液,无明显现象 | 证明Ksp(BaSO4)> Ksp(BaCO3) |
| B | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液,前者溶液变蓝色,后者有黄色沉淀 | 证明KI3溶液中存在I3-?I2+I-平衡 |
| C | 向NaAlO2溶液中持续通入气体Y,先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
| D | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 证明氧化性:H2O2比Fe3+强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和水反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 碳酸钙与醋酸溶液反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | Na2S水解的离子方程式:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com