
现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大,相关信息如下表所示:
| 元 素 | 性 质 |
| A | 一种核素的原子核内不含中子 |
| B | 原子核外电子有6种不同运动状态 |
| C | 最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E | 在地壳中的含量位居第三 |
| F | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| G | 该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨 |
(1) ; O>S>Al(2)甲酸形成分子间氢键(3)sp2杂化; V形; ①②(4)离子键、共价键(配位键);(5)原子; 酸性; Al3++3H2O
; O>S>Al(2)甲酸形成分子间氢键(3)sp2杂化; V形; ①②(4)离子键、共价键(配位键);(5)原子; 酸性; Al3++3H2O Al(OH)3+3H+;
Al(OH)3+3H+;
(6)Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O。
解析试题分析:根据题意可推知个元素分别是A是H;B是C;C是N;D是O;E是Al;F是S;G是Fe. (1)画出元素N的基态原子核外电子排布图为 。元素的非金属性越强,其失去电子就越难,第一电离能就越大。所以D、E、F三种元素的第一电离能的大小顺序是:O>S>Al.(2)化合物CH2O2为甲酸。其蒸气在293K时理论测算密度为1.9g/L,而由于在甲酸分子之间存在着氢键,所以实际密度为2.5g/L. (3)在SO2中S原子的杂化类型为sp2杂化;分子空间构型为V形;SO2是极性分子,H2O是极性分子,根据相似相容原理可知由极性分子组成的溶质容易溶解于极性分子组成的溶剂中,此外SO2会和水发生反应SO2+H2O=H2SO3.反应不断消耗SO2也使它不断的溶解。因此SO2易溶于水。(4)化合物NH5可写为NH4H的结构为含有离子键、共价键、配位键的离子化合物。(5)金刚石是原子晶体,硬度大,可制作手表的轴承,由于该物质性质与金刚石相似,所以该晶体类型也是原子晶体。Al2(SO4)3是强酸弱碱盐,水解使溶液显酸性。水解的离子方程式为:Al3++3H2O
。元素的非金属性越强,其失去电子就越难,第一电离能就越大。所以D、E、F三种元素的第一电离能的大小顺序是:O>S>Al.(2)化合物CH2O2为甲酸。其蒸气在293K时理论测算密度为1.9g/L,而由于在甲酸分子之间存在着氢键,所以实际密度为2.5g/L. (3)在SO2中S原子的杂化类型为sp2杂化;分子空间构型为V形;SO2是极性分子,H2O是极性分子,根据相似相容原理可知由极性分子组成的溶质容易溶解于极性分子组成的溶剂中,此外SO2会和水发生反应SO2+H2O=H2SO3.反应不断消耗SO2也使它不断的溶解。因此SO2易溶于水。(4)化合物NH5可写为NH4H的结构为含有离子键、共价键、配位键的离子化合物。(5)金刚石是原子晶体,硬度大,可制作手表的轴承,由于该物质性质与金刚石相似,所以该晶体类型也是原子晶体。Al2(SO4)3是强酸弱碱盐,水解使溶液显酸性。水解的离子方程式为:Al3++3H2O Al(OH)3+3H+;(6)Fe元素的可用作油漆颜料一种氧化物M为Fe2O3. 它可用作制备一种“绿色”环保高效净水剂K2FeO4。该反应为氧化还原反应。由于Fe的化合价Fe2O3--- K2FeO4从+3---+6,升高3×2,N的化合价KNO3—KNO2从+5—+3.降低2,根据化合价升高与降低的总数相等可知:Fe2O3系数为1,K2FeO4的系数为2,KNO3、KNO2的系数都是3,再结合反应前后各元素的原子个数相等,则由于生成物中含有H、K、O比反应物多可确定反应物还应该有KOH,其系数为4,。水的系数为2.所以该反应的化学方程式为Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O。
Al(OH)3+3H+;(6)Fe元素的可用作油漆颜料一种氧化物M为Fe2O3. 它可用作制备一种“绿色”环保高效净水剂K2FeO4。该反应为氧化还原反应。由于Fe的化合价Fe2O3--- K2FeO4从+3---+6,升高3×2,N的化合价KNO3—KNO2从+5—+3.降低2,根据化合价升高与降低的总数相等可知:Fe2O3系数为1,K2FeO4的系数为2,KNO3、KNO2的系数都是3,再结合反应前后各元素的原子个数相等,则由于生成物中含有H、K、O比反应物多可确定反应物还应该有KOH,其系数为4,。水的系数为2.所以该反应的化学方程式为Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O。
考点:考查元素的推断、元素及化合物的结构、性质、制法等知识。


科目:高中化学 来源: 题型:填空题
四种短周期非金属元素A、B、C、D原子序数依次增大。A是原子半径最小的元素,B原子的最外层电子数是次外层电子数的两倍,D在地壳中含量最大。请回答:
(1)B元素的原子结构示意图是
(2)化合物CA3的电子式是 ,BD2分子的结构式为
(3)丙为含有上述四种元素的常见无机酸式盐,则丙的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2
W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1 HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1 HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期主族元素X、Y、Z、W、M、N 的原子序数依次增大,且原子最外层电子数之和为23。X 的原子半径比Y 的小,X 与W 同主族,Z 的最外层电子数是电子层数的3倍,M 是地壳中含量最高的金属元素。
(1)M的离子结构示意图____________,X、Y形成的含18电子的化合物的电子式____________
用电子式表示由W、Z形成的只含离子键的化合物的形成过程______________________
(2)Y、Z、M原子半径由大到小的顺序____________(用元素符号表示),Z的氢化物稳定性_____N的氢化物稳定性(填“>” “<”或 “=”)
(3)X和Z组成的化合物中,既含有极性共价键又含有非极性共价键的是_________(填化学式),此化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨气,相应的离子方程式为:___________________________________________________________。
(4)由以上元素中两种或多种组成的化合物A、B、C、D有下列转化关系:
已知A溶液显碱性,可促进水的电离,用离子方程式表示A溶液显碱性的原因___________________,写出A与D反应的离子方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表前四周期常见的四种元素,原子序数依次增大。X原子核外有两种形状的电子云,四种伸展方向,常温下以双原子分子存在,性质稳定;Y的单质是生活中常见的合金材料成分之一,原子核外只有一个未成对电子,Z原子的半径比X大,其基态原子最外层的p电子是该层s电子的两倍,W是最常见的黑色金属之一。
(1)Z位于元素周期表中的位置是 ,W3+的最外层电子排布式是______,X的氧化物XO2与H2O比较,熔点较高的是______ (填化学式)。
(2)加热条件下,Z的单质与足量的X的最高价氧化物的水化物的浓溶液反应,生成Z的最髙价含氧酸,写出此反应的化学方程式 。.
(3)比较Y、W性质的活泼性 (用一个化学反应方程式表示)。
(4)2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒PM2.5。汽车尾气净化的主要原理为:2NO(g)+2CO(g)  2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。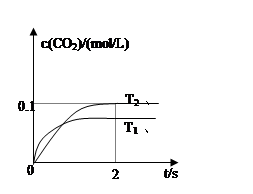
据此判断:
该反应为 反应(放热、吸热);在T2温度下,0~2s内的平均反应速率:υ(N2)= ;
(5)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,
在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(6)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量和质量)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素的主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
 2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图。该反应的△H 0(填“>”、“<”或“=”,下同);若T1、T2时该反应的化学平衡常数分别为K1、K2,则K1 K2。
2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图。该反应的△H 0(填“>”、“<”或“=”,下同);若T1、T2时该反应的化学平衡常数分别为K1、K2,则K1 K2。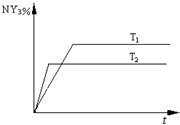
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在元素周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此请回答:
(1)锂在空气中燃烧,除生成______________外,也生成微量的________________。
(2)若已知反应Be2C+4H2O=2Be(OH)2+CH4↑,则Al4C3遇足量强碱溶液反应的离子方程式为_____________________________________________________________。
(3)科学家证实,BeCl2是共价化合物,可以设计一个简单实验证明,该实验方法是:____________________________________________________________________________。
用电子式表示BeCl2的形成过程:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如图所示,其中Z元素原子最外层电子数是电子层数的2倍。请回答下列问题: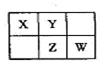
(1)W的最高价氧化物化学式是 ;Z的原子结构示意图为 。
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为 。
(3) AW3可用于净水,其原理是 。(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应。下列措施中既能提高反应速率,又能提高原料转化率的是___ _。
a.升高温度
b.加入催化剂
c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
(5)标准状况下,2.24L X的简单气态氢化物被100 mL l mol L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示) 。
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成两种无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式___ _。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)某短周期主族元素的原子M层上有一个半充满的亚层,这种原子的质子数是 ___________,写出它的外围电子排布图___________。
(2)VIA族的.硒(Se).在化合物中常表现出多种氧化态, H2SeO4比H2SeO3酸性_-___( 填强或弱),H2Se的酸性比H2S__________(填“强”或“弱”)。
(3)固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法中正确的是 ( )
| A.NH5中既有离子键又有共价键 |
| B.NH5的熔、沸点高于NH3 |
| C.NH5固体投入少量水中,可产生两种气体 |
| D.0.1 mol NH5中含有5 mol N—H键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com