
【题目】已知:在298K、100kPa时,
①C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1;
②2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1;
③2C2H2(g)+5O2(g)=4CO2(g)+ 2H2O(l) △H3=-2599kJ·mol-1;
则反应2C(s,石墨)+H2(g)=C2H2(g)的反应热△H为( )
A.-237.46kJ·mol-1B.+226.7kJ·mol-1
C.-226.7kJ·mol-1D.+237.46kJ·mol-1
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】Na2O2可用作漂白剂和呼吸面具中的供氧剂。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①使酚酞溶液变红是因为__________,红色褪去的可能原因是__________________。
②加入MnO2反应的化学方程式为________________________________。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
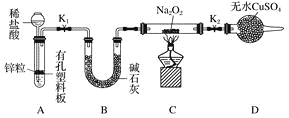
步骤1:按上图组装仪器(图中夹持仪器省略),检查气密性,装入药品。
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象。
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①添加稀盐酸的仪器名称是____________;B装置的作用是________。
②必须检验氢气纯度的原因是__________________________________________________。
③设置装置D的目的是________________________________________________________。
④你得到的结论是____________(若能反应请用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:______与盐酸反应最剧烈,____与盐酸反应的速度最慢;____与盐酸反应产生的气体最多.
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为______________________________;
(3)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_________,________________;
Ⅱ.利用图装置可验证同主族元素非金属性的变化规律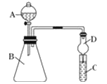
(4)干燥管D的作用为_______________;
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液________________________的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有______________溶液的洗气瓶.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是![]()
A.检验稀盐酸和氢氧化钠溶液是否恰好完全反应,可在反应后溶液中滴加无色酚酞溶液,无明显现象,恰好完全反应
B.某液体可能是海水或蒸馏水,将其蒸发结晶,液体消失,无残留物,该液体为蒸馏水
C.某溶液完全蒸发后无固体残留物,该溶液中一定含硫酸根离子
D.某溶液中加入稀盐酸有气泡产生,该溶液中一定含碳酸根离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题:
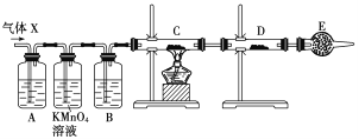
(1)上述反应中生成二氧化硫的化学方程式为______________________________。
(2)乙同学认为还可能产生氢气的理由是__________________________________。
(3)丙同学在安装好装置后,必不可少的一步操作是________________________。
(4)A中加入的试剂可能是_____,作用是__________________________________;B中加入的试剂可能是_____,作用是__________________________________;E中加入的试剂可能是_____,作用是__________________________________。
(5)可以证明气体X中含有氢气的实验现象是:C中:_________________________,D中:_________________________ 。如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?_____ (填“能”或“不能”),原因是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,x、y分别是直流电源的两极,通电后发现a极极板处有无色、无味的气体放出,b极极板质量增加,符合这一情况的是( )
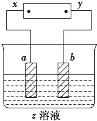
选项 | a极板 | b极板 | x电极 | z溶液 |
A | 锌 | 石墨 | 正极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 石墨 | 银 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
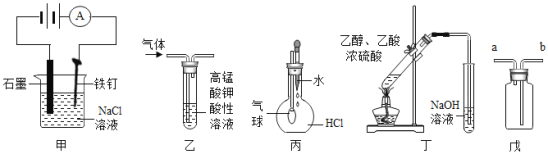
①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体
A.①⑤B.②④C.③④D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N | C—H |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 | 414 |
则该反应的ΔH=_________kJ·mol-1。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) CH3OH(g) ΔH <0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
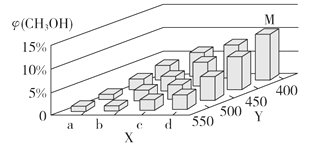
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为_________。
②X轴上a点的数值比b点_________ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是________________________________。
(3)工业上可采用CH3OH CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为_________(填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。
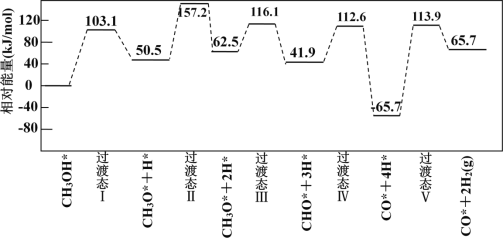
该历程中,放热最多的步骤的化学方程式为______________________________________________。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则Ksp(PbI2)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨气可以与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置可以实现该反应。实验时C中粉末逐渐变为红色,D中出现无色液体。下列有关说法正确的是

A.反应中氧化剂和还原剂的物质的量之比为2∶3
B.装置D中液体可以使干燥的红色石蕊试纸变蓝
C.装置B中加入的物质可以是碱石灰或无水氯化钙
D.为防止装置D中发生倒吸,可以改用向下排空气法收集氮气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com