
 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物进行相互反应,生成无毒物质;或者使用新型燃料电池作汽车动力,减少汽车尾气污染.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物进行相互反应,生成无毒物质;或者使用新型燃料电池作汽车动力,减少汽车尾气污染.
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c (NO)(×10-3 mol•L-1) | 1.00 | 0.50 | 0.20 | 0.10 | 0.10 |
| c (CO)(×10-3 mol•L-1) | 3.00 | 2.50 | 2.20 | 2.10 | 2.10 |
分析 (1)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
根据盖斯定律,②-①可得:2H2(g)+2NO(g)=N2(g)+2H2O(l);
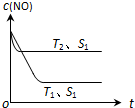
(2)①根据到达平衡的时间,判断温度高低,再根据不同温度下到达平衡时NO的浓度高低,判断温度对平衡的影响,据此判断反应热效应;
②催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,据此作图;
(3)反应为:2CO(g)+2NO(g)?2CO2(g)+N2(g),
①结合图表数据计算得到前2s内的△c (CO2);
②利用图表数据和化学平衡三行计算分别列式计算得到前2s内的平均反应速率v (N2);
③3s反应达到平衡状态,NO物质的量浓度1×10-3 mol•L-1 变化为0.1×10-3 mol•L-1,转化率=$\frac{消耗量}{起始量}$×100%.
解答 解:(1)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
根据盖斯定律,②-①可得:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1 kJ•mol-1,
故答案为:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1 kJ•mol-1;
(2)①温度T2到达平衡的时间短,反应速率快,故温度T2>T1,温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,
故答案为:<;
②催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,故c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为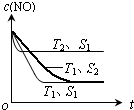 ,故答案为:
,故答案为: ;
;
(3)2CO(g)+2NO(g)?2CO2(g)+N2(g)
起始浓度(×10-3 mol•L-1) 3.00 1.00 0 0
2s末浓度(×10-3 mol•L-1) 2.20 0.20 0.80 0.40
2s变化浓度(×10-3 mol•L-1)0.80 0.80 0.80 0.40
平衡浓度(×10-3 mol•L-1) 2.10 0.10 0.90 0.45
①△c (CO2)=0.80 mol•L-1,答:前2s内的△c (CO2)为0.80 mol•L-1 ;
②v (N2)=$\frac{0.40molL}{2s}$=0.20 mol•L-1•s-1,
答:0.20 mol•L-1•s-1 ;
③依据上述三行计算得到平衡时NO的转化率为$\frac{1.00×1{0}^{-3}-0.1×1{0}^{-3}}{1.00×1{0}^{-3}}$×100%=90%,
答:达到平衡时NO的转化率为90%.
点评 本题主要考查化学反应速率、影响化学平衡的因素、化学平衡图象以及热化学方程式的书写等,注意根据“先拐先平数值大”原则判断温度高低是关键,作图时注意到达平衡的时间与平衡时NO的浓度,难度不大.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.| 化学键 | N-N | N=N | N≡N | N-H | H-H |
| 键能/kJ•mol-1 | 159 | 418 | 946 | 391 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
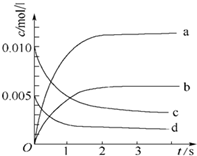 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
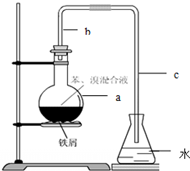
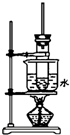 如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石棉网).
如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石棉网).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
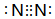 .
. NH3•H2O
NH3•H2O  NH4++OH-.
NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲烷与丙烷互为同系物 | |
| B. | 甲烷的一氯代物只有一种结构证明甲烷是正四面体结构而非平面正方形结构 | |
| C. | 甲烷、乙烷、丙烷中的化学键都是极性共价键 | |
| D. | 乙烷和氯气在光照的条件下可发生取代反应,生成多种氯代烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com