
【题目】TiO2在工业生产和日常生活中有重要用途。
工业上用钛铁矿(主要成分是TiO2、少量FeO和Fe2O3)制备TiO2,再用TiO2制备TiCl4等产品的一种工艺流程如图所示:
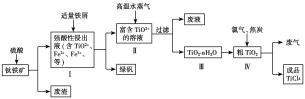
已知:TiO2+发生水解反应的化学方程式为TiO2++(n+1)H2O![]() TiO2·nH2O+2H+。
TiO2·nH2O+2H+。
(1)硫酸与TiO2反应的离子方程式是_________________________。
(2)由TiO2制取TiCl4时涉及的反应有:
TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH1=-72 kJ·mol-1;
TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g)
ΔH2=+38.8 kJ·mol-1;
C(s)+CO2(g)===2CO(g)
ΔH3=+282.8 kJ·mol-1。
①反应C(s)+CO2(g)===2CO(g)在高温下能够自发进行的原因是____________________。
②反应C(s)+O2(g)===CO2(g)的ΔH=________。
(3)向Ⅰ中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:2Fe3++Fe===3Fe2+;2TiO2+(无色)+Fe+4H+===2Ti3+(紫色)+Fe2++2H2O;Ti3+(紫色)+Fe3++H2O===TiO2+(无色)+Fe2++2H+。
①结合信息判断Fe3+、TiO2+、Fe2+的氧化性强弱关系:________>________>________。
②加入铁屑的作用是_____________________。
(4)向Ⅱ中不断通入高温水蒸气,维持溶液沸腾一段时间,析出水合二氧化钛沉淀。请用化学平衡理论分析通入高温水蒸气的作用:_________________________。
(5)依据绿色化学理念,该工艺流程中存在的不足之处是_________________________(写出一条即可)。
(6)工业上可通过电解TiO2来获得Ti(同时产生O2):处理过的TiO2为阴极,石墨为阳极,熔融CaCl2为电解液,电解槽中加入炭块。阴极反应式为_____________________;
电解过程中需定期向电解槽中加入炭块的原因是______________________。
【答案】
【解析】(1)根据Ⅰ中溶液的成分,钛元素以TiO2+的形式存在,故硫酸与TiO2反应生成TiO2+,离子方程式为TiO2+2H+===TiO2++H2O。(2)根据ΔG=ΔH-TΔS,ΔH>0,高温下能够自发进行的原因是该反应为熵增反应。将给出的3个反应标为a、b、c,根据盖斯定律由a-b-c可得C(s)+O2(g)===CO2(g)的ΔH=-393.6 kJ·mol-1。(3)①氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,由第2个式子知氧化性TiO2+>Fe2+,由第3个式子知Fe3+>TiO2+,则有Fe3+>TiO2+>Fe2+。②向Ⅰ中加入铁屑至浸出液显紫色,根据离子的颜色可知溶液中含有Ti3+,由第3个式子可知Fe3+能将Ti3+氧化为TiO2+,故加入铁屑作还原剂,将Fe3+还原为Fe2+,保护Fe2+不被氧化。(4)水解反应是吸热反应,通入高温水蒸气使体系的温度升高,促进TiO2+的水解,溶液被稀释,H+浓度降低,平衡正向移动,也促进TiO2+的水解。(5)根据工艺流程可看出生产过程中产生了废气、废液、废渣,对环境有污染,不符合绿色化学思想。(6)熔融CaCl2为电解液,处理过的TiO2为阴极,TiO2得电子生成Ti;阳极反应式为2O2--4e-===O2↑,石墨为阳极,碳单质与阳极产生的氧气反应而不断减少,需定期向电解槽中加入炭块。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A. 表示硫的燃烧热的热化学方程式S(s)+![]() O2(g)=SO3(g);ΔH=-315 kJ·mol-1
O2(g)=SO3(g);ΔH=-315 kJ·mol-1
B. 表示中和热的热化学方程式NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.3 kJ·mol-1
C. 表示H2燃烧热的热化学方程式H2(g)+![]() O2(g)=H2O(g);ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g);ΔH=-241.8 kJ·mol-1
D. 表示CO燃烧热的热化学方程式2CO(g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁、铝合金投入一定浓度的100 mL盐酸中,使合金全部溶解,向所得溶液中滴加5.00 mol/L的NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液的体积的关系如图所示。
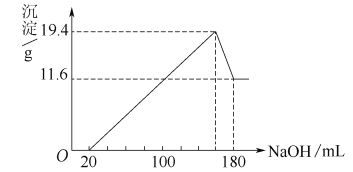
试求:(1)原合金中铝的质量分数。
(2)盐酸的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“类推”这种思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是( )
①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈,性质更活泼的铝不能稳定存在于空气中
③Al(OH)3、Cu(OH)2受热易分解,Fe(OH)3受热也易分解
④不能用电解熔融 的AlCl3来制取金属铝;也不能用电解熔融的MgCl2来制取金属镁
A.①④ B.②④
C.①②④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在搪瓷和陶瓷器皿具表面的釉质中含有极微量的Pb、Cd、Sb等有毒金属盐类,为防止中毒,不能长期盛放下列物质的是
A. 食醋 B. 酱油 C. 蔗糖 D. 食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用如图装置制取溴苯并证明苯和液溴发生的是取代反应。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
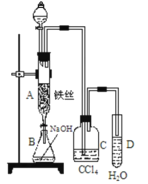
(1)写出 A 中发生反应的化学方程式_____________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是__________,写出有关反应的离子方程式____________。
(3)C中盛放 CCl4的作用是___________________。
(4)为证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液, 若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入___________,现象是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B为单质,C为化合物,能实现上述转化关系的是( )
![]()
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.①③
C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaoH溶液的体积关系如下图所示。 若不考虑金属和盐酸反应时HCI的挥发,则下列说法不正确的是( )
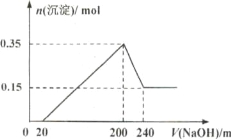
A.镁和铝的总质量为9 g
B.盐酸的物质的量浓度为10 mol/L
C.NaOH溶液的物质的量浓度为5 mol/L
D .生成的氢气在标准状况下的体积为11.2 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com