
某强酸性溶液X可能含有Ba2+、Al3+、NH 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO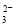 、SO
、SO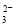 、SO
、SO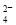 、Cl-、NO
、Cl-、NO 中的一种或几种,取该溶液进行连续实验,实验过程如下:
中的一种或几种,取该溶液进行连续实验,实验过程如下:
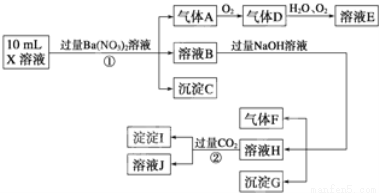
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是______,不能确定是否含有的离子(M)是______,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是______.
(2)写出反应②的离子方程式:______.
(3)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式______.
(4)假设测定A、F、I均为0.1mol,10mL X溶液中n(H+)=0.4mol,当沉淀C物质的量大于0.7mol时,溶液X中还一定含有______.
(1)NH4+、Fe2+、SO42- ;Fe3+、Cl- 取少量X溶液于试管中,加入几滴KSCN溶液,溶液不变红色则说明无Fe3+;或取少量B溶液于试管中,加入几滴AgNO3溶液,若无白色沉淀说明无Cl-
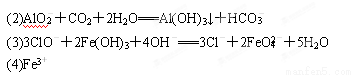
【解析】
试题分析:据题意可知X为强酸性溶液所以CO32-、SO32不能存在X溶液中,加入过量Ba(NO3)2溶液生成沉淀C是BaSO4,说明有SO42-存在;加入硝酸钡,还可以产生气体,原因只能是硝酸被还原生成气体A为NO,说明有还原剂Fe2+存在,(即3Fe2++4H++NO3-=3Fe3++NO↑+2H2O).再由溶液B加入过量NaOH溶液,能产生沉淀,则说明该生成的沉淀G为
Fe(OH)3;生成的气体F为NH3,说明有NH4+存在.再由溶液H通入CO2生成沉淀I,由于前面加入过量的Ba(NO3)2溶液,引入了大量Ba2+,所以沉淀I中一定有BaCO3,又由于前面不能确定溶液X中是否存在A13+,所以这里也不能确定沉淀I中有A1(OH)3;上述实验过程还不能确定溶液X中是否存在C1-.
考点:考查常见离子的检验,如氨气的检验、铝离子的检验


科目:高中化学 来源:2013-2014浙江省高二下学期期中化学试卷(解析版) 题型:选择题
下列关于有机物说法正确的是 ( )
A.制乙酸乙酯时,把乙醇和乙酸依次加入浓硫酸中
B.纤维素和淀粉都是多糖,二者互为同分异构体
C.煤的干馏是物理变化,煤的气化和液化是化学变化
D.三大合成材料是塑料、合成纤维和合成橡胶
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省杭州市高二年级教学质量检测模拟卷化学试卷(解析版) 题型:选择题
美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁—过氧化氢燃料电池系统。其工作原理如图所示。以下说法中错误的是
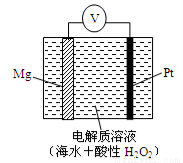
A.电池的负极反应为:Mg – 2e-= Mg2+
B.电池的正极产生的还原产物是水
C.电池工作时,H+向负极移动
D.电池工作一段时间后,溶液的pH增大
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高三高考模拟理综化学试卷(解析版) 题型:简答题
工业上可以利用废气中的CO2为原料制取甲醇,其反应方程式为:CO2+3H2 CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
(1)已知常温常压下下列反应的能量变化如下图所示:
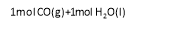
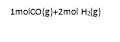


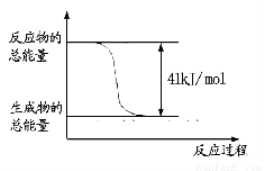

写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。
该反应的△S____0(填“>”或“<”或“=”),在 ______情况下有利于该反应自发进行。
(2)如果上述反应方程式的平衡常数K值变大,则该反应__ (选填编号)。
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,能说明反应已达到平衡状态的是 __ (选填编号)。
A.3v正(H2)=v逆(CO2) B.C(H2) = C(CO2)
C.容器内气体的密度不变 D.容器内压强不变
(4)若反应的容器容积为2.0L,反应时间4.0 min,容器内气体的密度增大了2.0g/L,在这段时间内CO2的平均反应速率为 。反应在t1时达到平衡,过程中c(CO2)随时间t变化趋势曲线右图所示。保持其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。

查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高三高考模拟理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 用新制氢氧化铜悬浊液可检验失去标签的乙醇、丙三醇、乙醛、乙酸四瓶无色溶液
B.检验氯乙烷中的氯元素时,可先将氯乙烷硝酸进行酸化,再加硝酸银溶液来检验,通过观察是否有白色沉淀来判断是否存在氯元素
C. 摩尔盐制备过程中铁屑要先用碳酸钠溶液浸泡洗涤,使用热的碳酸钠溶液有利提高去油污的能力,最后分离溶液和固体时不可以用倾析法
D. 由于苯酚与溴水发生反应时,副反应多,所以只能利用溴水对含苯酚的废水作定性检验,不能用作定量测定
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
已知:还原性强弱:I― >Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
A.1.1mol·L-1 B.1.5mol·L-1 C.1.2mol·L-1 D.1.0mol·L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
向盛有NaHSO4溶液的烧杯中不断滴Ba(OH)2溶液,随着Ba(OH)2溶液的不断滴入,溶液中产生的沉淀量与pH变化情况正确的是

查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性溶液中可以发生反应产生Cl2,下列关于混盐CaOCl2的有关判断不正确的是(NA为阿伏加德罗常数)
A.该混盐在酸性溶液中产生1mol Cl2时转移的电子数为NA
B.该混盐的水溶液具有漂白性
C.该混盐中氯元素的化合价为+1和-1价
D.该混盐具有较强的还原性
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省宁波市高一下学期期末考试化学试卷(解析版) 题型:填空题
工业上电解制碱的技术是用阳离子交换膜法,主要原料是饱和食盐水。下图为阳离子交换膜法电解原理示意图:
请回答下列问题:
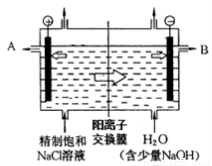
(1)A极为电解槽的________极,B极的材料工业上常采用的是生活中常见的金属,但有大量损耗,其主要原因是 。(填“吸氧腐蚀”或“析氢腐蚀”)
(2)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,这种阳离子交换膜,只允许溶液中的__________通过(填写下列微粒的编号)。
①H2,②Cl2,③H+,④Cl-,⑤Na+,⑥OH-。
(3)若上述电解过程中用阴离子交换膜代替阳离子交换膜(已知:3Cl2 +6OH-==5Cl-+ClO3-+3H2O),下列说法正确的组合是 。
A.电解结束时,右侧溶液中含有ClO3—
B.电解槽内发生反应的总化学方程式为:NaCl + 3H2O  NaClO3 + 3H2↑
NaClO3 + 3H2↑
C.用阴离子交换膜后,电解槽内两个电极发生的电极反应与原来一样
D.用阴离子交换膜后,阳离子的定向移动方向与原来相反
(4)已知某电解槽每小时加入10%的氢氧化钠溶液a kg,每小时能产生标准状况下的氯气b L,则电解后流出的氢氧化钠溶液(密度为d g·cm-3)的物质的量浓度为(理论计算,需化简) mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com