
| A. | Na2SiO3 | B. | BaCl2 | C. | AgNO3 | D. | NaAlO2 |
分析 先判断盐酸与各选项物质是否发生反应,若反应是否有白色沉淀生成,再判断白色沉淀是否溶于盐酸,以此解答该题.
解答 解:A.Na2SiO3与HCl反应:Na2SiO3+2HCl=2NaCl+H2SiO3↓,生成H2SiO3白色沉淀,不溶于盐酸,继续滴加稀盐酸,沉淀不溶解,故A错误;
B.加入盐酸,不发生反应,没有沉淀生成,故B错误;
C.反应生成AgCl沉淀,故C错误;
D.NaAlO2与HCl反应:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,生成Al(OH)3白色沉淀,继续滴加盐酸,Al(OH)3又与HCl反应:Al(OH)3+3HCl=AlCl3+3H2O,沉淀溶解,故D正确.
故选D.
点评 本题考查物质之间的反应,为高频考点,侧重学生的分析能力的考查,注意现象是反应的体现,关键是清楚物质的性质及物质间的反应,注重基础知识的积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
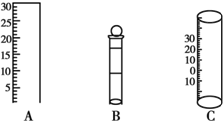 如图所示为中学化学实验中几种常见仪器的部分结构:
如图所示为中学化学实验中几种常见仪器的部分结构:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ② | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | 氯水中含有Cl- |
| ② | 将氯水滴加到含有酚酞的NaOH溶液中 | 溶液褪色 | |
| ③ | 取一小片KI淀粉试纸,置于表面皿或玻璃片上,用洁净的玻璃棒蘸取氯水,滴在试纸上 | 淀粉-KI试纸变蓝色 | 氯水中含有Cl2 |
| ④ | 将足量的氯水滴加到Na2CO3溶液中 | 出现气泡 | 氯水中含有H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
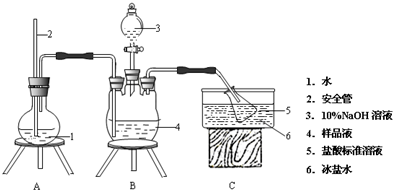
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0~15 s 内用 I2 表示的平均反应速率为:v(I2)=0.001 mol•L-1•s-1 | |
| B. | c(HI)由 0.07 mol•L-1 降到 0.05 mol•L-1 所需的反应时间小于 10 s | |
| C. | 升高温度正反应速率加快,逆反应速率减慢 | |
| D. | 减小反应体系的体积,化学反应速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com