


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.Cu2+、SO42-、OH- | B.Al3+、Cl-、Ca2+ |
| C.NO3-、Fe2+、H+ | D.Fe3+、SCN-、K+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
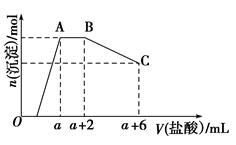
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| KMnO4酸性溶液浓度 (mol·L-1) | 溶液褪色所需时间(min) | | ||
| 第一次 | 第二次 | 第三次 | ||
| 0.02 | 14 | 13 | 11 | |
| 0.002 | 6.7 | 6.6 | 6.7 | |
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/ mol/L | 体积(ml) | 浓度/ mol/L | 体积(ml) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
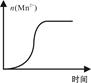
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O= AlO2-↓+4NH4++2H2O |
| B.钠投入水中:Na+H2O=Na++2OH-+H2↑ |
| C.铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
| D.氢氧化钡溶液滴入稀硫酸中:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变 |
| B.向溶液中滴入无色的KSCN溶液,显血红色 |
| C.Fe2+和Fe3+的物质的量之比为5:1 |
| D.氧化产物与还原产物的物质的量之比为2:5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH3的水溶液可以导电,说明NH3是电解质 |
| B.标准状况下,6.72 L NO2气体与水完全反应转移电子数为1.204×1023 |
| C.向水中通入氯气发生反应的离子方程式为:Cl2+H2O=2H++Cl-+ClO- |
| D.加入铝片能放出H2的溶液中可能大量共存的离子:Na+、NO3-、NH4+、SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向该溶液中加入KI溶液后,原有的五种离子物质的量不变 |
| B.向该溶液中滴加稀氢氧化钠溶液,立即出现白色沉淀 |
| C.若溶液中c(Cl-)=0.6 mol·L-1,则该溶液的pH为1 |
| D.向该溶液中加入过量铁粉,只发生置换反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
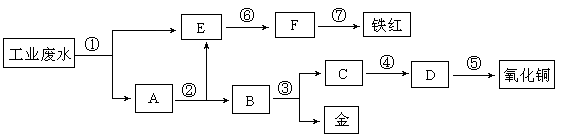
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com