
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示: 
(1)请列举海水淡化的一种方法 .
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、、 .
(3)步骤Ⅰ中已经获得Br2 , 步骤Ⅱ中又将获得的Br2还原为Br﹣ , 其目的是
(4)步骤Ⅱ用SO2水溶液吸收Br2 , 吸收率可达95%,该反应的离子方程式为 . 由此反应可知,除保护环境外,在工业生产中还应解决的问题是 .
【答案】
(1)蒸留法或电渗透法或离子交换法等
(2)NaOH;Cl2
(3)富集溴元素
(4)SO2+Br2+2H2O═4H++2Br﹣+SO42﹣;强酸对设备的严重腐蚀
【解析】解:(1)目前淡化海水的方法有多种,如:蒸留法、电渗透法、离子交换法、水合物法、溶剂萃取法和冰冻法;所以答案是:蒸留法或电渗透法或离子交换法等;(2)电解饱和食盐水生成氢气、氯气、氢氧化钠,2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑,所以答案是:NaOH;Cl2;(3)步骤Ⅰ中已获得Br2 , 步骤Ⅱ中又将Br2还原为Br﹣ , 目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,所以答案是:富集溴元素;(4)二氧化硫吸收溴单质发生反应:Br2+SO2+2H2O═4H++SO42﹣+2Br﹣ , 工业生产中应解决的主要问题是反应生成了两种强酸,易腐蚀设备,所以答案是:SO2+Br2+2H2O═4H++2Br﹣+SO42﹣;强酸对设备的严重腐蚀.
2NaOH+Cl2↑+H2↑,所以答案是:NaOH;Cl2;(3)步骤Ⅰ中已获得Br2 , 步骤Ⅱ中又将Br2还原为Br﹣ , 目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,所以答案是:富集溴元素;(4)二氧化硫吸收溴单质发生反应:Br2+SO2+2H2O═4H++SO42﹣+2Br﹣ , 工业生产中应解决的主要问题是反应生成了两种强酸,易腐蚀设备,所以答案是:SO2+Br2+2H2O═4H++2Br﹣+SO42﹣;强酸对设备的严重腐蚀.


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 若把H2S分子写成H3S分子,违背了共价键的饱和性
B. H3O+离子的存在,说明共价键不应有饱和性
C. 所有共价键都有方向性
D. 两个原子轨道发生重叠后,两核间的电子仅存在于两核之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A分子的立体结构如图(其中C、H原子已略去);因其分子中碳原子排列类似金刚石故名“金刚烷”,关于金刚烷分子的说法中错误的是( ) 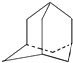
A.分子中有4个 ![]() 结构
结构
B.分子中有4个由六个碳原子构成的碳环
C.金刚烷分子式是C10H16
D.金刚烷分子的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.5.6 g铁粉与硝酸反应失去电子数一定为0.3×6.02×1023
B.反应MgCl2(s)═Mg(s)+Cl2(g)的△H<0、△S>0
C.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
D.0.1 mol?L﹣1 Na2SO3溶液中:c(OH﹣)﹣c(H+)=2c(H2SO3)+c(HS ![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一个原子形成的离子可表示为abXn-,下列有关该原子的说法正确的是( )
A. 含有的中子数为a+bB. 含有的电子数为a-n
C. 质量数为a+b+nD. 1mol该原子的质量约为bg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)如图所示,在101kPa时,△H1=﹣393.5kJmol﹣1 , △H2=﹣395.4kJmol﹣1 , 下列说法正确的是( ) 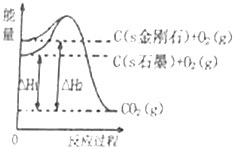
A.石墨的燃烧热为393.5kJ/mol
B.石墨转变成金刚石需要吸收能量,是物理变化
C.石墨比金刚石稳定
D.1mol金刚石与1molO2的总能量低于1molCO2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同元素的原子电负性不同,若用x值来表示,x值越大,其原子的电负性就越大,吸引电子的能力越强,在所形成的分子中成为带负电荷的一方,下面是某些短周期元素的电负性的值:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
第二周期 | Li | Be | B | C | N | O | F |
电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | |
第三周期 | Na | Mg | Al | Si | P | S | Cl |
电负性值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析x值的变化规律,确定N、Mg的x值的范围:<x(Mg)< , <x(N)< .
(2)推测x值与原子半径的关系是 . 根据短周期元素x值变化特点,体现了元素性质的变化规律.
(3)某有机物结构简式如图,其中C﹣N中,你认为共用电子对偏向原子(填原子名称). 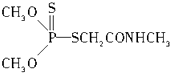
(4)经验规律告诉我们,当成键的两原子的x差值,即△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键.试推断AlBr3中化学键的类型为
(5)预测元素周期表中x值最小的元素是(填元素符号,放射性元素除外).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和.
(1)C离子的结构示意图为 . D在周期表中位置 .
(2)写出E的电子式: .
(3)A、D两元素形成的化合物属(填“离子”或“共价”)化合物.
(4)写出D的最高价氧化物的水化物和A反应的化学方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com