
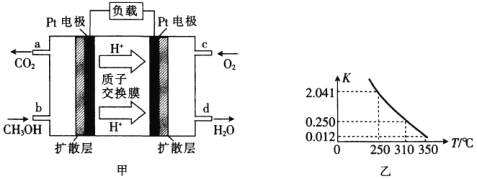
【题目】(1)甲醇一空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图甲所示,该电池中正极的电极反应式为_____。
(2)工业上合成甲醇一般采用下列反应:![]() ,
,![]() ,图乙是该反应在不同温度下的化学平衡常数(K):
,图乙是该反应在不同温度下的化学平衡常数(K):
①由图中数据判断a_______0(填“>”“=”或“<”)。
②某温度下,将2molCO和6molH2充入2L的恒容密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol·L-1,则此时的温度为________℃。
(3)T℃时,在恒容密闭容器中发生反应:![]() ,各物质的浓度变化如图丙所示:
,各物质的浓度变化如图丙所示:
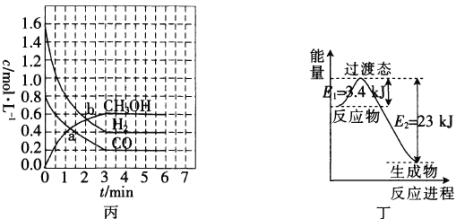
①反应从0min到3min之间,CH3OH的反应速率为________________。
②CO在0~1min和1~3min时平均反应速率[平均反应速率分别以v(0~1),v(1~3)表示]的大小为_____________________________。
(4)目前工业上有一种方法是用CO2和H2在230℃、催化剂条件下转化生成甲醇蒸气和水蒸气。图丁表示恒压容器中0.5molCO2和1.5molH2反应时转化率达80%的能量变化示意图。写出该反应的热化学方程式:_________________________________。
【答案】O2+4e-+4H+=2H2O < 310℃ 0.2mol/(L·min) > CO2+3H2=CH3OH+H2O H=-49kJ/mol
【解析】
(1)根据图像可知,正极上氧气得电子,与质子结合生成水;
(2)根据图像信息,确定K及温度的关系进行计算;
(3)①根据图像可知,0~3mim时甲醇的浓度变化为0.6mol/L;
②CO为反应物,开始浓度大,反应速率快,平均值也快,随反应的进行浓度逐渐减小,反应速率减慢,平均值降低;
(4)反应方程式为CO2+3H2=CH3OH+H2O,根据参加反应的二氧化碳的物质的量计算焓变。
(1)根据图像可知,正极上氧气得电子,与质子结合生成水,电极反应式为O2+4e-+4H+=2H2O;
(2)①根据图乙可知,升高温度,K减小,平衡逆向移动,则逆向反应为吸热反应,正方应放热,H<0;
② CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
初始(mol):2 6 0
反应(mol):1 2 1
平衡(mol):1 4 1
K=0.5/(22×0.5)=0.25,温度为310℃;
(3)①根据图像可知,0~3mim时甲醇的浓度变化为0.6mol/L,v(CH3OH)=0.6mol/L÷3min=0.2mol/(L·min);
②CO为反应物,开始浓度大,反应速率快,平均值也快,随反应的进行浓度逐渐减小,反应速率减慢,平均值降低,则v(0~1)>v(1~3);
(4)反应方程式为CO2+3H2=CH3OH+H2O,二氧化碳为0.5mol,转化率为80%,则参加反应的物质的量为0.4mol,释放的热量为23 kJ-3.4 kJ=19.6kJ,因此1mol时释放19.6kJ÷0.4=49kJ,则H=-49kJ/mol,因此该反应的热化学方程式为CO2+3H2=CH3OH+H2O H=-49kJ/mol。


科目:高中化学 来源: 题型:
【题目】实验室通过称量![]() 样品受热脱水前后的质量来测定x值,下列情况会导致测定值偏低的是( )
样品受热脱水前后的质量来测定x值,下列情况会导致测定值偏低的是( )
A. 实验前试样未经干燥B. 试样中含有少量碳酸氢铵
C. 试样中含有少量氯化钠D. 加热过程中有试样迸溅出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)![]() D(g)+E(g)△H=QkJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g)△H=QkJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的物质的量如表:
物质的量(mol) 时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T℃时,该反应的平衡常数K=___________。
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是______(填字母编号)。
a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2mol B、0.1molD、0.1mol E
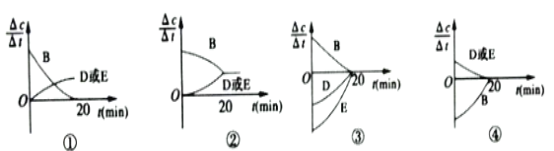
(3)对于该反应,用各物质的反应速率与时间的关系曲线表示如下,示意图中的___________(填序号)正确。
(4)容器的体积和温度T1℃不变,向该容器中加入1.60molB、0.20molD、0.20molE和0.4molA,达到平衡后,与表格中20分钟时各物质的浓度完全相同,投入固体A的物质的量n的取值范围是___________。
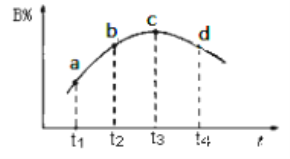
(5)若该密闭容器绝热,实验测得B的转化率随温度变化如图所示。由图可知,Q_________0(填“大于”或“小于),c点v正__________v逆(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
(1)若12.4 g Na2X中含有0.4 mol钠离子,Na2X的摩尔质量是________,X的相对原子质量是________。
(2)标准状况,1L 水中通入 aL HCl 气体,忽略盐酸溶液中 HCl的挥发,得到的盐酸溶液密度为 b g/mL,则溶质的物质的量浓度为 __________mol/L
(3)某同学写出以下化学方程式(未配平)NO+HNO3―→N2O3+H2O该应中氧化剂是________(写化学式,下同) ;方程中出现的4种物质中还原性最强的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH溶液至滴定终点,消耗NaOH溶液的体积为Vx、Vy,则

A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KA1(SO4)2·12H2O]是一种复盐,在造纸等方面应用广泛。采用废易拉罐制备明矾的过程如下图所示。
下列叙述错误的是
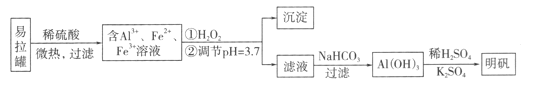
A. 合理处理易拉罐有利于环境保护和资源再利用
B. 从易拉罐中可回收的金属元素有Al、Fe
C. “沉淀”反应的金属离子为Fe3+
D. 上述流程中可用NaHSO4代替NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铵是一种常见的化肥,某工厂用石膏、NH3、H2O、CO2制备硫酸铵的工艺流程如下:
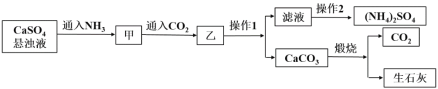
下列说法不正确的是
A. 操作1为过滤,操作2为蒸馏
B. 滤液中的主要阳离子可通过向少量滤液中加NaOH溶液,加热,并用湿润的红色石蕊试纸来检验
C. 甲到乙反应的离子方程式为CaSO4+2NH3+CO2+H2O==CaCO3↓+2NH4++ SO42-
D. 工艺流程中产生的CO2可循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国最新战机歼-31使用了高强度、耐高温的钛合金材料。工业上冶炼钛的反应:TiCl4+2Mg==Ti+2MgCl2,下列有关该反应的说法正确的是()

A. TiCl4是还原剂
B. Mg得到电子
C. TiCl4发生氧化反应
D. Mg被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)典型物质的电子式
NH4Cl:__________Na2O2:________CO2:___________-OH:__________
(2)某短周期元素含氧酸的化学式为HXO3,其气态氢化物的化学式为HX,则X元素在周期表中的位置为_______。
(3)石油的综合利用方法有四种,其中____的目的是提高轻质油的产量,_____主要是得到甲烷、乙烯、丙烯等化工原料,_______是从石油中获得苯、甲苯等化工原料。
(4)填写有机除杂试剂
C2H6(C2H4) __________
乙酸乙酯(乙酸或乙醇)_____
乙醇(水)____________
苯(溴)________________
(5)无机方程式书写
①海带提碘的氧化环节,使用稀硫酸酸化的双氧水氧化I-的离子方程式为_______
②海水提溴吸收塔(SO2的水溶液)中的反应离子方程式为__________
③以金红石(主要成分TiO2)为原料生产金属钛的步骤主要有:
a.高温下,向金红石与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体__________
b.在稀有气体(如氩)氛围和加热条件下,用镁与TiCl4反应可得到钛_____
(6)有机方程式书写
①乙醇去氢催化氧化生成乙醛的化学方程式:_______
②对苯二甲酸与乙二醇在一定条件下发生缩聚反应生成涤纶的化学方程式:___
③苯的硝化反应____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com