工业生产无铁硫酸铝,以硫酸浸取铝土矿(主要成分是Al
2O
3,还有少量的Fe
2O
3、SiO
2)得含铁(Fe
3+)的硫酸铝溶液,加热到一定温度,搅拌,加入一定量高锰酸钾溶液和硫酸锰溶液,在溶液中生成活性二氧化锰,调节溶液的pH,反应一段时间,二氧化锰和Fe (OH)
3发生吸附共沉作用,最终得到无铁硫酸铝产品.
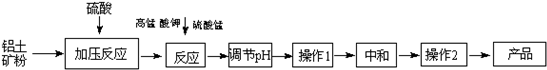
(1)硫酸浸取铝土矿时主要反应的离子方程式为
Al2O3+6H+=2Al3++3H2O
Al2O3+6H+=2Al3++3H2O
;
(2)完成高锰酸钾溶液和硫酸锰溶液反应的化学方程式:2KMnO
4+3MnSO
4+2H
2O=
5MnO2↓+K2SO4+2H2SO4
5MnO2↓+K2SO4+2H2SO4
;
(3)调节pH的作用是
使铁离子转化为氢氧化铁沉淀除去
使铁离子转化为氢氧化铁沉淀除去
;
(4)操作1的名称为
过滤
过滤
,实验室进行操作2用到的陶瓷质仪器有
蒸发皿(泥三角)
蒸发皿(泥三角)
;
(5)下列有关工艺的说法正确的是
AC
AC
(双选,填字母).
A.可以向溶液中再加入铝土矿粉等调节pH
B.溶液的碱性越强,则除铁效果越好,而且不会影响硫酸铝的产率
C.活性二氧化锰生成量应适宜,不足时铁的去除率较低,过量时会增加成本
D.可以直接向溶液中加入二氧化锰粉末以除去Fe (OH)
3.



 步步高达标卷系列答案
步步高达标卷系列答案