
| A. | 使用的NaOH固体在空气中敞口放置了一段时间 | |
| B. | 容量瓶用蒸馏水洗净后,未经干燥 | |
| C. | 在烧杯中溶解NaOH后,未经冷却即将溶液转入容量瓶 | |
| D. | 调节天平零点时未将游码回到最左边 |
分析 根据C=$\frac{n}{V}$判断是否对配制溶液浓度有影响,如果n偏大或V偏小都导致C偏高.
解答 解:A.氢氧化钠易潮解,导致n偏小,则配制溶液浓度偏低,故A错误;
B.容量瓶使用前未干燥,对n或V无影响,所以对配制溶液浓度无影响,故B错误;
C.溶解后,未冷却即将溶液转入容量瓶,热的溶液体积偏大,冷却后溶液体积变小,导致配制的溶液体积偏小,浓度偏大,故C正确;
D.使用托盘天平测物体的质量时,未将游码拨至左侧零位,就调节横梁平衡,称量前就有读数值,实际质量偏小,导致n偏小,则配制溶液浓度偏低,故D错误.
故选C.
点评 本题考查了误差分析,根据C=$\frac{n}{V}$判断来分析判断是否对配制溶液浓度有影响,易错选项是B,注意容量瓶是否干燥对该实验无影响,难度不大.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 颜色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 浅黄色 | 5.4×10-13 |
| AgI | 黄色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 红色 | 2.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的分子式:CH2=CH2 | |
| B. | NaHCO3的电离:HCO3-+H2O?H3O++CO32- | |
| C. | NaOH的结构式:Na-O-H | |
| D. | NH4Cl的电子式: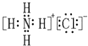 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,E原子的价电子排布式为3s23p5,F在周期表中的位置是第四周期第IVB族.
,E原子的价电子排布式为3s23p5,F在周期表中的位置是第四周期第IVB族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
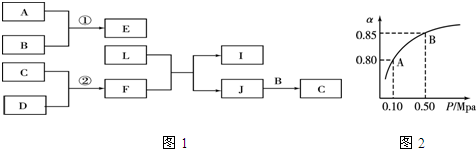
 ;J的结构式
;J的结构式 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com