
(12分)镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下: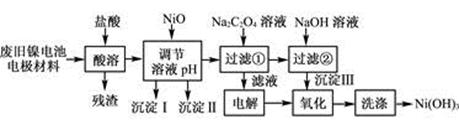
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)n | Ksp | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
(1) Fe(OH)3 Al(OH)3(各1分,共2分)
(2) NiCl2+Na2C2O4+2H2O=NiC2O4·2H2O↓+2NaCl(3分)
(3) 用湿润的淀粉碘化钾试纸(2分)
(4) 2Ni(OH)2+2OH-+Cl2=2Ni(OH)3+2Cl-(3分)
(5) 取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净(2分)
解析试题分析:解:(1)根据表中开始沉淀和沉淀完全pH,Fe(OH)3开始沉淀pH=2.5,沉淀完全pH=2.9,Al(OH)3开始沉淀pH=3.4,沉淀完全pH=4.2,故为:Fe(OH)3 Al(OH)3;
(2)NiCl2可与Na2C2O4反应生成NiC2O4?2H2O和NaCl,故方程式为:NiCl2+Na2C2O4+2H2O═NiC2O4?2H2O↓+2NaCl
(3)滤液为氯化钠溶液,电解时阳极产生氯气,氯气有强氧化性,故可用湿润的淀粉碘化钾试纸;
(4)过滤2得到Ni(OH)2电解滤液1产生氯气,二者发生氧化还原反应,离子方程式为2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-,故答案为:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-
(5)取最后一次洗涤浸出液,加入硝酸银溶液,若有白色沉淀生成,则说明未洗涤干净,若无白色沉淀,说明已洗涤干净。
考点:金属的回收与环境、资源保护;难溶电解质的溶解平衡及沉淀转化的本质。
点评:本题考查化学反应原理中的电化学,化学方程式的书写,离子的检验等,难度适中。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| M(OH)n | Ksp | ||
| pH | |||
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| M(OH)n | Kap | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省高三1月月考化学试卷(解析版) 题型:填空题
(12分)镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
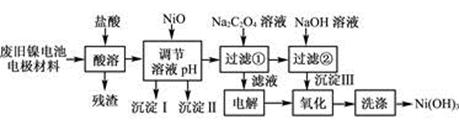
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
|
M(OH)n |
Ksp |
开始沉淀pH |
沉淀完全pH |
|
Al(OH)3 |
1.9×10-23 |
3.4 |
4.2 |
|
Fe(OH)3 |
3.8×10-38 |
2.5 |
2.9 |
|
Ni(OH)2 |
1.6×10-14 |
7.6 |
9.8 |
回答下列问题:
(1) 用NiO调节溶液的pH,依次析出沉淀Ⅰ________和沉淀Ⅱ__________(填化学式)。
(2) 写出加入Na2C2O4溶液的反应的化学方程式:
。
(3) 检验电解滤液时阳极产生的气体的方法:
。
(4) 写出“氧化”反应的离子方程式:
。
(5) 如何检验Ni(OH)3已洗涤干净?
。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省南京市高三第四次模拟考试(理综)化学部分 题型:实验题
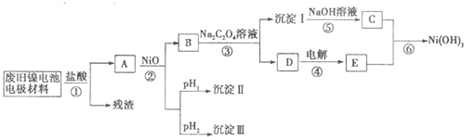
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
|
M(OH)n |
Ksp |
|
|
|
pH |
|
|
|
|
开始沉淀 |
沉淀完全 |
|
|
|
Al(OH)3 |
1.9×10-23 |
3.4 |
4.2 |
|
Fe(OH)3 |
3.8×10-38 |
2.5 |
2.9 |
|
Ni(OH)2 |
1.6×10-14 |
7.6 |
9.8 |
回答下列问题:
(1) 用NiO调节溶液的pH,依次析出沉淀Ⅰ________和沉淀Ⅱ__________(填化学式)。
(2) 写出加入Na2C2O4溶液的反应的化学方程式: 。
(3) 检验电解滤液时阳极产生的气体的方法: 。
(4) 写出“氧化”反应的离子方程式: 。
(5) 如何检验Ni(OH)3已洗涤干净? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com