
【题目】芳香族化合物A(![]() )是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如下图所示:
)是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如下图所示:
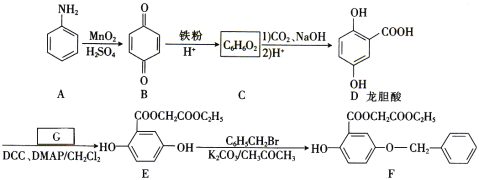
(1)A的分子式是______,B含有的官能团的名称是_________。
(2)D→E的反应类型是_________。
(3)已知G能与金属钠反应,则G的结构简式为________。
(4)写出E→F的化学方程式:_________。
(5)龙胆酸D的同分异构体有多种,符合下列条件的有___种。写出其中一种核磁共振氢谱有六组峰的同分异构体的结构简式:____。
①能发生银镜反应;②与FeCl3溶液发生显色反应;③1mol该物质能与2mol Na2CO3反应。
(6)已知: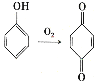 。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(
。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(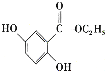 )的合成路线(无机试剂任用)。_________
)的合成路线(无机试剂任用)。_________
【答案】C6H7N 碳碳双键、羰基 取代反应(或酯化反应) HOCH2COOC2H5 ![]() +C6H5CH2Br
+C6H5CH2Br![]()
![]() +HBr 6
+HBr 6 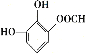 、
、 、
、 或
或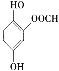 (任写一种)
(任写一种) 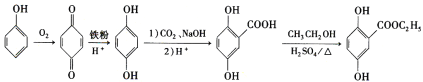
【解析】
(1)根据结构简式写出其分子式;由B的结构简式可确定其含有的官能团;
(2)根据D→E的官能团变化判断其反应类型;
(3)结合G的化学性质及反应路线作答;
(4)E→F中,E的一个酚羟基中的H原子被苯甲基(![]() )取代生成F;
)取代生成F;
(5)龙胆酸D的同分异构体能发生银镜反应,与FeCl3溶液发生显色反应,且1 mol该物质能与2 mol Na2CO3反应,说明该龙胆酸的同分异构体分子的苯环上连接有一个HCOO—和两个—OH,分析讨论其同分异构体的种类;其中核磁共振氢谱有六组峰的同分异构体中不含等效氢原子,结构无对称性,据此作答;
(6)结合题目中B→C→D制备龙胆酸的流程,先将苯酚氧化制得![]() ,进而制得龙胆酸,再利用酯化反应制得龙胆酸乙酯。
,进而制得龙胆酸,再利用酯化反应制得龙胆酸乙酯。
(1)结合芳香族化合物A的结构简式(![]() )可知其为苯胺,其分子式为C6H7N。由B的结构简式可确定其含有的官能团名称为碳碳双键与羰基,
)可知其为苯胺,其分子式为C6H7N。由B的结构简式可确定其含有的官能团名称为碳碳双键与羰基,
故答案为:C6H7N;碳碳双键、羰基;
(2)D→E发生酯化反应,所以其反应类型为:取代反应(或酯化反应);
(3)G能与金属钠反应,说明G中可能含有羟基或羧基,D和G反应生成E,对比D和E的结构简式可确定G的结构简式为HOCH2COOC2H5,
故答案为:HOCH2COOC2H5;
(4)E→F中,化学方程式为:![]() +C6H5CH2Br
+C6H5CH2Br![]()
![]() +HBr;
+HBr;
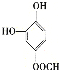
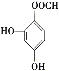
(5)龙胆酸D的同分异构体能发生银镜反应,与FeCl3溶液发生显色反应,且1 mol该物质能与2 mol Na2CO3反应,说明该龙胆酸的同分异构体分子的苯环上连接有一个HCOO—和两个—OH。两个—OH在苯环上的位置有邻、间、对三种情况,对应HCOO—的位置分别有2种、3种、1种,即符合条件的同分异构体共有6种;其中核磁共振氢谱有六组峰的同分异构体中不含等效氢原子,结构无对称性,共有4种,分别是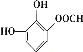 、
、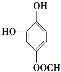 、
、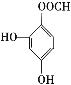 、
、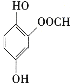 ,
,
故答案为:6;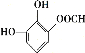 、
、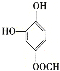 、
、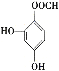 或
或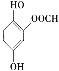 (任写一种);
(任写一种);
(6)结合题目中B→C→D制备龙胆酸的流程,具体合成路线可表示为: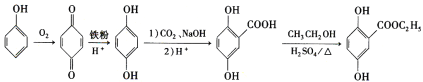 ,
,
故答案为: 。
。


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】实验室测定水体中氯离子含量,实验过程如下:向水样中加入K2CrO4溶液作指示剂,用0.0010 mol·L-1AgNO3溶液滴定至终点。已知:Ag2CrO4为不溶于水的砖红色沉淀;常温下Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)= 1.8×10-12。回答下列问题:
(1)滴定时,应使用____________(填“酸式”或“碱式”) 滴定管。
(2)滴定达到终点的标志是___________________________________________。
(3)实验过程中测得数据如下表:
编号 | 1 | 2 | 3 |
V(水样)/mL | 10.00 | 10.00 | 10.00 |
V(AgNO3)/mL | 3.75 | 4.01 | 3.99 |
计算水样中氯离子的含量为_______________mg/L(保留2位小数)
(4)滴定结束后:
①当溶液中的残余c(Cl-)=1.8×10-5mol/L,则此时溶液中c(CrO42-)=____________ mol·L-1。
②已知2AgCl+ CrO42-![]() 2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
(5)下列情况会造成实验测定结果偏低的是____________。(填标号)
A.锥形瓶洗涤后未干燥 B.滴定前,未使用标准液润洗滴定管
C.滴定管滴定前仰视读数,滴定后俯视读数
D.滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池结构如图所示,其中电解质![]() 溶于混合有机溶剂中,
溶于混合有机溶剂中,![]() 通过电解质迁移入
通过电解质迁移入![]() 晶格中生成
晶格中生成![]() 。下列有关说法正确的是
。下列有关说法正确的是

A. 外电路电流方向:a→b
B. 电池正极反应式为:![]()
C. 可以用水代替电池中的混合有机溶剂
D. 用该电池给铅蓄电池充电,a极与Pb电极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青出于蓝而胜于蓝,“青”指的是靛蓝,是人类使用历史悠久的染料之一,下列为传统制备靛蓝的过程:
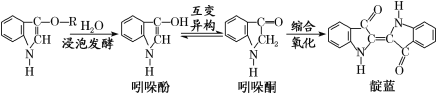
下列说法不正确的是( )
A. 靛蓝的分子式为C16H10N2O2
B. 浸泡发酵过程发生的反应为取代反应
C. 吲哚酚的苯环上的二氯代物有4种
D. 1 mol吲哚酚与H2加成时可消耗4 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究。
(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:
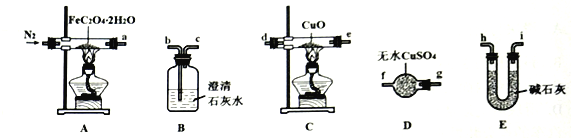
①装置D的名称为___________。
②按照气流从左到右的方向,上述装置的连接顺序为___________→尾气处理装置(填仪器接口的字母编号)。
③实验前先通入一段时间N2,其目的为______________________。
④实验证明了气体产物中含有CO,依据的实验现象为______________________。
(2)固体产物成分的探究。充分反应后,A处反应管中残留黑色固体。查阅资料可知,黑色固体可能为Fe或FeO。小组成员设计实验证明了其成分只有FeO,其操作及现象为___________。
(3)依据(1)和(2)结论,可知A处反应管中发生反应的化学方程式为___________。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取m g草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液。
步骤2:取上述溶液25.00mL,用c mol· L -1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤3中加入锌粉的目的为____________________________________________。
(5)草酸亚铁晶体样品的纯度为____________________________________________;若步骤1配制溶液时部分Fe2+被氧化,则测定结果将___________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是病人输液用的葡萄糖(分子式为C6H12O6)注射液的标签上的部分内容。据标签所提供的信息,以下说法错误的是( )
5%葡萄糖注射液
500 mL
(性状)本品为无色或几乎为无色的透明液体
(规格)500 mL 25 g
(贮藏)密封保存
A. 该注射液中葡萄糖的质量分数是5%
B. 葡萄糖的摩尔质量为180 g·mol-1
C. 该注射液的密度约为1g·cm-3
D. 该注射液中葡萄糖的物质的量浓度约为0.014mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大型客机燃油用四乙基铅[Pb(CH2CH3)4])做抗震添加剂,但皮肤长期接触四乙基铅对身体健康有害,可用硫基乙胺(HSCH2CH2NH2)和KMnO4清除四乙基铅。
(1)锰元素在周期表中的位置是_____,基态锰原子的外围电子排布式为_____,该原子能量最高的电子的电子云轮廓图形状为____。
(2)N、C和Mn电负性由大到小的顺序为_____。
(3)HSCH2CH2NH2中C的杂化方式为____,其中NH2-空间构型为____;N和P的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是____。
(4)Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于_____晶体。已知Pb(CH2CH3)4晶体的堆积方式如下。
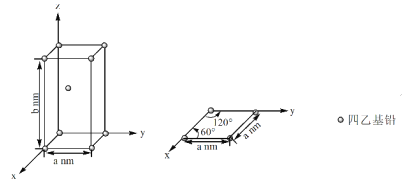
Pb(CH2CH3)4]在xy平面上的二维堆积中的配位数是______。设阿伏加德罗常数为NA/mol,Pb(CH2CH3)4]的摩尔质量为Mg/mol,则Pb(CH2CH3)4]晶体的密度是_____g/cm3 (列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物中间体Q、医用材料PVA的合成路线如下。
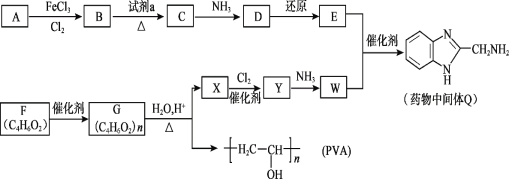
已知:![]()
(1)A的分子式是C6H6,A→B的反应类型是_______。
(2)B→C是硝化反应,试剂a是_______。
(3)C→D为取代反应,其化学方程式是_______。
(4)E的结构简式是_______。
(5)F含有的官能团是________。
(6)G→X的化学方程式是________。
(7)W能发生聚合反应,形成的高分子结构简式是________。
(8)将下列E +W→Q的流程图补充完整(在虚线框内写出物质的结构简式):__________________
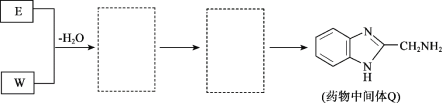
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《 Journal of Energy Chemistry》报导我国科学家设计CO2熔盐捕获与转化装置如图。下列有关说法正确的是
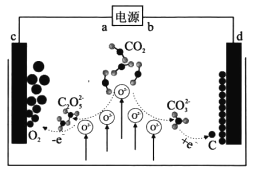
A. a为负极
B. 熔盐可用KOH溶液代替
C. d极电极反应式为CO32-+4e-===C+3O2-
D. 转移lmol电子可捕获CO211.2L(标况下)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com