
| A. | $\overline{v}$(O2)=0.01mol/(L•s) | B. | $\overline{v}$(NO)=0.08mol/(L•s) | ||
| C. | $\overline{v}$(H2O)=0.0013mol/(L•s) | D. | $\overline{v}$(NH3)=0.002mol/(L•s) |
分析 根据v(NO)=$\frac{\frac{△n}{V}}{△t}$计算NO的反应速率,再根据同一可逆反应中,同一时间段内,各种物质的反应速率之比等于其计量数之比计算其它气体的反应速率.
解答 解:v(NO)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.3mol}{5L}}{30s}$=0.002mol/(L•s),
A.v(O2)=$\frac{5}{4}$v(NO)=$\frac{5}{4}$×0.002 mol/(L•s)=0.0025mol/(L•s),故A错误;
B.v(NO)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.3mol}{5L}}{30s}$=0.002 mol/(L•s),故B错误;
C.v(H2O)=$\frac{3}{2}$v(NO)=$\frac{3}{2}$×0.002mol/(L•s)=0.003 mol/(L•s),故C错误;
D.v(NH3)=v(NO)=0.002ol/(L•s),故D正确;
故选D.
点评 本题考查了化学反应速率的计算,明确同一可逆反应中同一时间段内各种物质的反应速率与其计量数之间的关系是解本题关键,灵活运用公式来分析解答,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
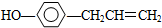 ,下列叙述中正确的是( )
,下列叙述中正确的是( )| A. | 1mol胡椒酚最多可与4mol氢气发生反应 | |
| B. | 1mol胡椒酚最多可与2mol溴发生反应 | |
| C. | 与FeCl3显紫色,因为该物质与苯酚属于同系物 | |
| D. | 胡椒酚在水中的溶解度大于苯酚在水中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
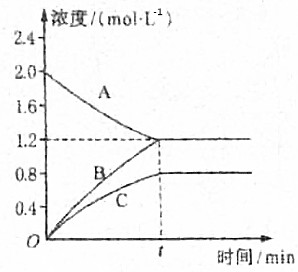 如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,试回答:
如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.00 | 19.90 |
| 第二次 | 25.00 | 0.00 | 20.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10B20为硼元素的一种原子 | B. | 10B20为硼元素的一种单质 | ||
| C. | 10B的中子数比核外电子数多 | D. | 10B的原子核外电子排布为 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
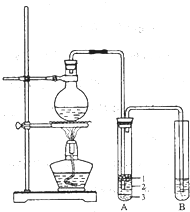 某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:
某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:| 乙醇 | 溴乙烷 | |
| 状态 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.8 | 1.4 |
| 沸点/℃ | 78.5 | 119.0 |
| 熔点/℃ | -l30 | 38.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
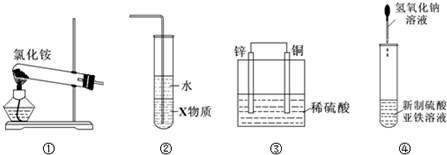
| A. | 实验室用装置①制取氨气 | |
| B. | 装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| C. | 装置③是原电池,锌电极为负极,发生还原反应 | |
| D. | 装置④可用于制备氢氧化亚铁并观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com