
分析 (1)氧化物A是常见的高熔点白色固体,具有两性,A在融熔状态下电解得到单质C和O2,则A为Al2O3,C为Al;
(2)氧化物B是黑色固体,B与浓盐酸加热反应生成单质D,则B为MnO2,单质D为Cl2;
(3)单质C与单质D反应生成M,其中单质C不溶于冷的浓硝酸,则C为Al,D为氯气,所以M为AlCl3;
(4)M与适量NaOH溶液反应生成沉淀G,则G为Al(OH)3;
(5)G与NaOH溶液反应得到溶液N;G与盐酸反应得到溶液M,则N为NaAlO2,然后结合物质的性质及化学用语来解答.
解答 解:氧化物A是常见的高熔点白色固体,具有两性,A在融熔状态下电解得到单质C和O2,则A为Al2O3,C为Al;
氧化物B是黑色固体,B与浓盐酸加热反应生成单质D,则B为MnO2,单质D为Cl2;
单质C与单质D反应生成M,其中单质C不溶于冷的浓硝酸,则C为Al,D为氯气,所以M为AlCl3;
M与适量NaOH溶液反应生成沉淀G,则G为Al(OH)3;
G与NaOH溶液反应得到溶液N;G与盐酸反应得到溶液M,则N为NaAlO2,
(1)由上述分析可知,A为Al2O3,D为Cl2,
故答案为:Al2O3;Cl2;
(2)元素C为Al,Al的原子序数为13,位于第三周期第ⅢA族,
故答案为:第三周期第ⅢA族;
(3)B+浓盐酸反应的化学方程式为:MnO2+4 HCl (浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
G+NaOH溶液反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O;
G为氢氧化铝,G+盐酸反应的化学方程式为:Al(OH)3+3HCl═AlCl3+3H2O,
故答案为:MnO2+4 HCl (浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2 H2O;Al(OH)3+NaOH=NaAlO2+2H2O;Al(OH)3+3HCl═AlCl3+3H2O.
点评 本题考查无机物的推断,把握物质的熔点、金属的冶炼、钝化为解答本题的突破口,侧重Al及其化合物及氯气的制法等知识点的考查,明确物质的性质及相互转化即可解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用浓硫酸做干燥剂 | |
| B. | 将火柴梗插入浓硫酸中,火柴梗很快变黑 | |
| C. | 铜与浓硫酸加热时发生反应 | |
| D. | 锌与稀硫酸发生置换反应制取氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳素钢、不锈钢、硬铝、黄铜都属于合金 | |
| B. | 正常雨水的pH为5.6,主要是因为溶解了SO2 | |
| C. | 钢化玻璃常用于制造眼镜片、照相机中的透镜等 | |
| D. | 光化学烟雾主要是由于向大气中任意排放CO2、氟氯烃、SO2等产生的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
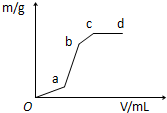 向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,关于图曲线的推测正确的是( )
向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,关于图曲线的推测正确的是( )| A. | ab段产生的沉淀为硫酸钡 | |
| B. | ab产生段的沉淀为氢氧化镁 | |
| C. | bc段产生的沉淀为氢氧化镁 | |
| D. | bc段产生的沉淀为硫酸钡和氢氧化镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产品在溶剂中的溶解度随温度升高而迅速增大 | |
| B. | 在溶剂中产品比杂质更难溶解 | |
| C. | 杂质在溶剂中的溶解度在高温或低温时都很大 | |
| D. | 室温时产品在溶剂中很易溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与Cu20的物质的量之比为2:1 | |
| B. | 硝酸的物质的量浓度为2.4mol/L | |
| C. | 产生的NO在标准状况下的体枳为4.48L | |
| D. | Cu、Cu20与硝酸反应后剩余HN03为lmol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
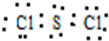 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com