

| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
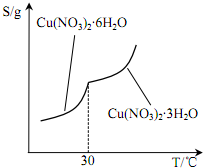
分析 粗铜中含有Fe,将粗铜溶于硝酸,因为硝酸过量,粗铜和硝酸反应生成硝酸铜、硝酸铁和氮氧化物,调节溶液的pH,将铁离子转化为氢氧化铁沉淀,然后过滤得到的滤渣为Fe(OH)3,向滤液中加入稀硝酸并调节溶液的pH至1,硝酸铜水解生成氢氧化铜导致产率降低,为防止硝酸铜水解,所以调节溶液的pH至1,然后蒸发浓缩、冷却结晶、过滤得到 Cu(NO3)2•6H2O;
(1)氮氧化物和氧气、水反应生成硝酸,从而减少氮氧化物的生成;
(2)①调节pH值为使Fe3+沉淀完全,加入的物质能和酸反应而调节溶液的pH值,且不能引进新的杂质;
②调节溶液的pH使铁离子完全转化为沉淀,而铜离子不能转化为沉淀;
(3)步骤3中,要用硝酸调节溶液的pH=1,硝酸具有酸性,能抑制硝酸铜水解;
(4)硝酸铜是强酸弱碱盐,铜离子水解导致溶液呈酸性,但其水解程度较小,硝酸根离子不水解,据此判断该溶液中各种离子浓度由大到小顺序;
(5)从溶液中得到晶体采用蒸发浓缩、冷却结晶的方法,然后过滤、洗涤、干燥得到晶体;温度高于30℃时,Cu(NO3)2•6H2O水生成Cu(NO3)2•3H2O.
解答 解:粗铜中含有Fe,将粗铜溶于硝酸,因为硝酸过量,粗铜和硝酸反应生成硝酸铜、硝酸铁和氮氧化物,调节溶液的pH,将铁离子转化为氢氧化铁沉淀,然后过滤得到的滤渣为Fe(OH)3,向滤液中加入稀硝酸并调节溶液的pH至1,硝酸铜水解生成氢氧化铜导致产率降低,为防止硝酸铜水解,所以调节溶液的pH至1,然后蒸发浓缩、冷却结晶、过滤得到 Cu(NO3)2•6H2O;
(1)氮氧化物和氧气、水反应生成硝酸,从而减少氮氧化物的生成,则减少空气污染,
故答案为:氮氧化物和氧气、水反应生成硝酸,从而减少氮氧化物的排放,则降低空气污染;
(2)①调节pH值为使Fe3+沉淀完全,加入的物质能和酸反应而调节溶液的pH值,且不能引进新的杂质,
ab都引进新的杂质,不符合;cd能和酸反应调节溶液的pH值,且不引进新的杂质,符合条件,
故选cd;
②调节溶液的pH使铁离子完全转化为沉淀,而铜离子不能转化为沉淀,根据表中数据知,则溶液的pH调节为3.2≤pH值<4.7,故答案为:3.2≤pH值<4.7;
(3)步骤3中,硝酸铜为强酸弱碱盐,铜离子水解生成氢氧化铜和硝酸,为防止铜离子水解,调节溶液的pH=1,
故答案为:硝酸铜水解生成氢氧化铜和硝酸,加入硝酸抑制硝酸铜水解,得到较纯净的Cu(NO3)2•6H2O;
(4)硝酸铜是强酸弱碱盐,铜离子水解导致溶液呈酸性,但其水解程度较小,硝酸根离子不水解,据此判断该溶液中各种离子浓度由大到小顺序为c(NO3-)>c(Cu2+)>c(H+)>c(OH-),故答案为:c(NO3-)>c(Cu2+)>c(H+)>c(OH-);
(5)从溶液中得到晶体采用蒸发浓缩、冷却结晶的方法,然后过滤、洗涤、干燥得到晶体;温度高于30℃时,Cu(NO3)2•6H2O水生成Cu(NO3)2•3H2O,为了得到较多的Cu(NO3)2•6H2O,温度控制在 25~30℃,
故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;温度高于30℃时,Cu(NO3)2•6H2O水生成Cu(NO3)2•3H2O.
点评 本题考查物质制备,为高频考点,侧重考查学生对化学工艺流程的理解和分析,明确流程图中发生的反应、基本操作、物质的成分及其性质是解本题关键,难点是(2)题pH值的调节范围判断,只要调节溶液的pH值大于铁离子完全沉淀而小于铜离子产生沉淀的即可.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol任何气体的体积都约是22.4 L | |
| B. | 18 g NH4+含有电子数为10NA | |
| C. | NA个H2SO4分子的质量等于H3PO4的摩尔质量 | |
| D. | 标准状况下,相同体积的O2、HCl含有的分子数都为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{n(A-N+8)}{A+16}$ | B. | $\frac{n(A-N+10)}{(A+16)}$ | C. | A-N+2 | D. | $\frac{n(A-N+6)}{A}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com